 |
التأين الذاتي للماء
Autoionization of Water
ثبت عملياً أن الماء النقي موصل ضعيف جداً للتيار الكهربائي، وهذا يدل على وجود أيونات موجبة وأخرى سالبة مسؤولة عن ذلك. إن مصدر هذه الأيونات هو التأين الذاتي للماء حيث يمكن لجزيء ماء أن يمنح بروتوناً لجزيء ماء آخر، فيسلك بذلك أحدهما سلوك الحمض والآخر سلوك القاعدة.
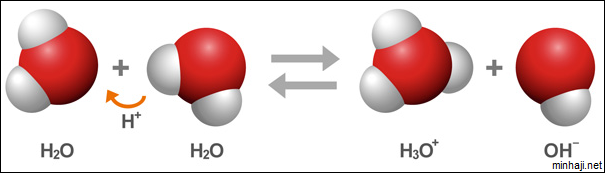
يعبر عن ثابت الاتزان (KC) للتأين الذاتي للماء كالتالي:
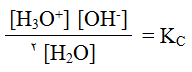
ونظراً لأن الماء يتأين بدرجة ضئيلة جداً فإن تركيزه يعد ثابتاً، وحيث أن ثابت الاتزان KC في التفاعل يعود للماء فقط، فإنه يعبر عنه باستخدام الرمز Kw ، ويسمى ثابت تأين الماء.
Kw = [OH-] [H3O+]
Kw : ثابت تأين الماء = 1 × 10-14 عند درجة 25هس.
تستخدم العلاقة السابقة لحساب تركيز أيون الهيدرونيوم أو أيون الهيدروكسيد في الماء أو أي محلول آخر.
حساب [H3O+] و [OH-] في الماء النقي
إن التأين الذاتي للماء يعطي تراكيز متساوية من أيونات H3O+ ، OH- .
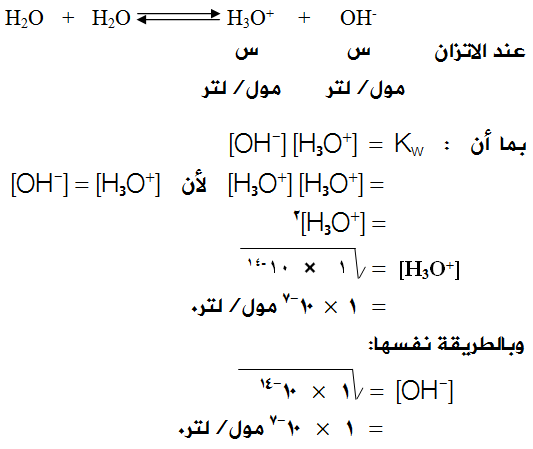
وعليه نقول:
في الماء النقي يكون [H3O+] = [OH-] = 1 × 10-7 مول/لتر.
أثر إضافة حمض أو قاعدة للماء النقي
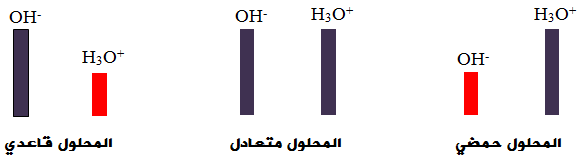
إضافة حمض إلى الماء يزيد من [H3O+] ويقلل من [OH-] مع بقاء قيمة Kw ثابتة.

وفي هذه الحالة يكون المحلول حمضياً لأن [H3O+] > 1 × 10-7 مول/لتر.
وكلما زاد [H3O+] زادت قوة المحلول الحمضي.
إضافة قاعدة إلى الماء يزيد من [OH-] ويقلل من [H3O+] مع بقاء قيمة Kw ثابتة.

وفي هذه الحالة يكون المحلول قاعدياً لأن [OH-] > 1 × 10-7 مول/لتر.
وكلما زاد [OH-] زادت قوة المحلول القاعدي.
والآن انظر إلى الجدول التالي:
|
[H3O+] |
> |
[OH-] |
المحلول حمضي |
|
[H3O+] |
= |
[OH-] |
المحلول متعادل |
|
[H3O+] |
> |
[OH-] |
المحلول قاعدي |
مثال:
احسب [OH-] في محلول يبلغ [H3O+] فيه 2 × 10-3 مول/لتر، وبيّن ما إذا كان المحلول حمضياً أم قاعدياً أم متعادلاً. (Kw = 1 × 10-14)
الإجابة:
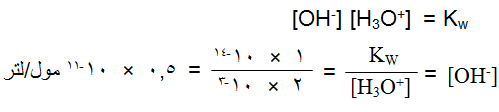
المحلول حمضي لأن [H3O+] < [OH-] أو لأن [H3O+] < أعلى من 1 × 10-7 مول/لتر
سؤال (1):
احسب [H3O+] في محلول يبلغ [OH-] فيه 5 × 10-6 مول/لتر، وبيّن ما إذا كان المحلول حمضياً أم قاعدياً أم متعادلاً. (Kw = 1 × 10-14)
سؤال (2):
أكمل الفراغات في الجدول التالي وصنف المحاليل إلى حمضية أم قاعدية أم متعادلة:
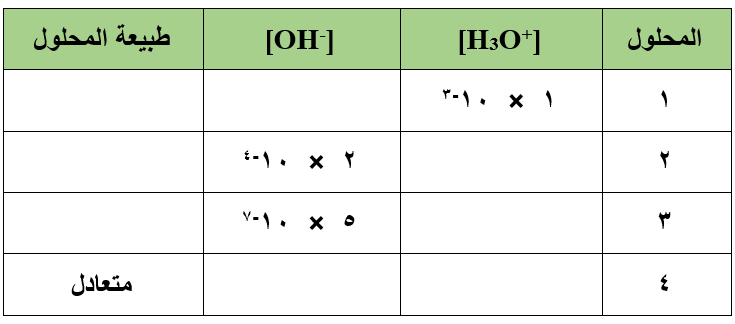
سؤال (3):
يبين الجدول أدناه قيم تركيز H3O+ و تركيز OH- في محاليل حموض وقواعد افتراضية متساوية التركيز:
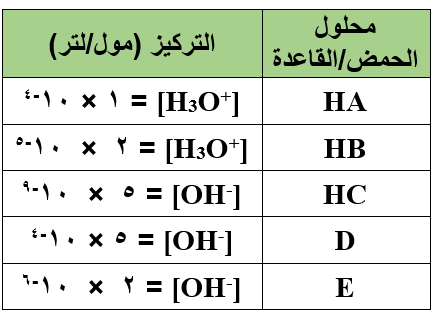
- أي المحاليل يعتبر محلولاً لحمض؟
- أي المحاليل يعتبر محلولاً لقاعدة؟
- حدد صيغة المحلول الأكثر حمضية.
- حدد صيغة المحلول الأكثر قاعدية.
- اكتب معادلة تفاعل أقوى الحموض مع أضعف القواعد وفق تعريف برونستد - لوري.