 |
أسئلة المحتوى وإجاباتها
الروابط الكيميائية
أستكشف صفحة (71):
نمذجة بناء المركبات الكيميائية
التحليل والاستنتاج:
1- أستنتج الفرق بين نموذج H2O ونموذج NaCl .
نموذج الماء H2O، تتشارك الإلكترونات لتكوين الروابط ليصبح الغلاف الأخير مكتمل.
نموذج NaCl ، تفقد ذرة الصوديوم إلكتروناً واحداً لتصل إلى حالة الاستقرار، وتكسب ذرة الكلور هذا الإلكترون ليصبح غلافها الأخير مكتمل وتصل إلى حالة الاستقرار.
2- أقارن نموذج مركب MgBr2 بنموذج مركب NaCl من حيث عدد الذرات المكونة لكل مركب.
ذرة المغنيسيوم لديها إلكترونين في الغلاف الأخير، وتميل لفقدهما لتصل لحالة الاستقرار، بينما كل ذرة بروم تميل لكسب إلكترون واحد لتصل لحالة الاستقرار، لذلك ترتبط ذرة المغنيسيوم بذرتي بروم، ويصبح الغلاف الأخير مكتمل، وبذلك تصل الذرات لحالة الاستقرار.
3- أفسر سبب اختلاف ترابط الذرات في النماذج التي ركبتها.
أتوصل إلى أن بعض المركبات تميل للتشارك في إلكترونات الغلاف الأخير، حتى تصل إلى حالة الاستقرار كما في مركب الماء H2O.
بينما هناك مركبات تميل ذراتها للفقد وأخرى تميل للكسب حتى تصل إلى حالة الاستقرار.
أتحقق صفحة (73):
ما المقصود بالرابطة الأيونية؟
الرابطة الأيونية: رابطة تنشأ بين ذرتين إحداهما تميل إلى فقد الإلكترونات، والأخرى إلى كسبها.
أفكر صفحة (74):
يرتبط المغنيسيوم Mg بالأكسجين O لتكوين مركب MgO ، فكيف يحدث ذلك؟
تميل ذرة المغنيسيوم إلى فقد إلكترونين من مستوى الطاقة الأخير حتى تصل إلى حالة الاستقرار، وتكوّن أيون المغنيسيوم الموجب (Mg2+)، في حين تميل ذرة الأكسجين إلى كسب إلكترونين حتى تصل إلى حالة الاستقرار، وتكون أيون الأكسجين السالب (O2-).
يرتبط أيون المغنيسيوم الموجب بأيون الأكسجين السالب، وتتكون بين الأيونين رابطة أيونية.
أفكر صفحة (75):
يرتبط الكالسيوم Ca بالأكسجين O لتكوين مركب CaO، فكيف يحدث ذلك؟
تميل ذرة الكالسيوم إلى فقد إلكترونين من مستوى الطاقة الأخير حتى تصل إلى حالة الاستقرار، وتكوّن أيون الكالسيوم الموجب (Ca2+)، في حين تميل ذرة الأكسجين إلى كسب إلكترونين حتى تصل إلى حالة الاستقرار، وتكون أيون الأكسجين السالب (O2-).
يرتبط أيون الكالسيوم الموجب بأيون الأكسجين السالب، وتتكون بين الأيونين رابطة أيونية.
أتحقق صفحة (76):
أوضح: ما المقصود بالأيون المتعدد الذرات؟
الأيون متعدد الذرات: أيون مكون من نوعين أو أكثر من الذرات، ويحمل شحنة سالبة أو موجبة.
أفكر صفحة (76):
ترتبط ذرة الألمنيوم بذرة البروم لتكوين مركب بروميد الألمنيوم، فما الصيغة الكيميائية لهذا المركب؟
AlBr3
أفكر صفحة (78):
ما صيغة المركب الناتج عن اتحاد أيون الصوديوم مع أيون الكبريتات؟
Na2SO4
أتحقق صفحة (78):
أكتب الصيغة الكيميائية لمركب بايكربونات البوتاسيوم.
KHCO3
أتحقق صفحة (80):
أوضح تكوين جزيء الفلور F2 باستخدام تركيب لويس.
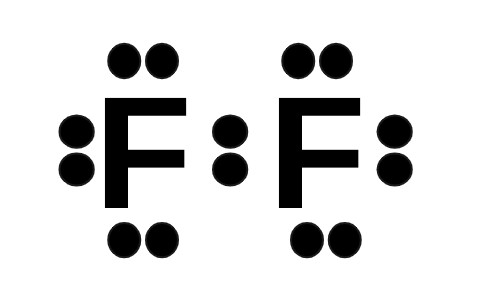
أتحقق صفحة (81):
ما المقصود بالرابطة التساهمية؟
الرابطة التساهمية: رابطة كيميائية تنشأ بين ذرتين من خلال التشارك في الإلكترونات.
أفكر صفحة (82):
أيهما أقوى الرابطة الأيونية في مركب أكسيد المغنيسيوم MgO أم كلوريد البوتاسيوم KCl ، علماً أنّ:
- درجة انصهار مركب أكسيد المغنيسيوم MgO تساوي 2852oC .
- درجة انصهار مركب كلوريد البوتاسيوم KCl تساوي 770oC .
الرابطة الأيونية في مركب أكسيد المغنيسيوم أقوى من الرابطة الأيونية في مركب كلوريد البوتاسيوم.
أتحقق صفحة (82):
أذكر الخصائص العامة للمركبات التساهمية.
- درجات غليانها وانصهارها منخفضة مقارنة بالمركبات الأيونية.
- غالبية المواد الأيونية غير موصلة للتيار الكهربائي.
تجربة صفحة (83):
الخصائص الفيزيائية للمركبات الأيونية والمركبات التساهمية
التحليل والاستنتاج:
1- أقارن: أيهما انصهر كلوريد الصوديوم أم السكر، ولماذا؟
السكر انصهر؛ لأن الروابط تساهمية.
2- أفسر: سبب إضاءة المصباح في إحدى الكؤوس وعدم إضاءته في الأخرى.
إضاءة المصباح بسبب وجود أيونات حرة الحركة في المركبات الأيونية توصل التيار الكهربائي مثل مركب NaCl
3- أستنتج: أيهما مركب أيوني، وأيهما تساهمي؟
عدم إضاءة المصباح بسبب عدم وجود أيونات كما في المركبات التساهمية مثل السكر.