 |
العوامل المؤثرة في الاتزان
Factors Affecting Equilibrium
مفهوم موضع الاتزان
عند وصول التفاعلات المنعكسة إلى حالة الاتزان، تثبت تراكيز كل من المواد المتفاعلة، والمواد الناتجة.
ولكن قد تكون تراكيز النواتج أعلى من المتفاعلات، لذا يكون الاتزان منزاحاً نحو النواتج، وقد تكون تراكيز المتفاعلات أعلى من النواتج، لذا يكون الاتزان منزاحاً نحو المتفاعلات، وهذا ما يعرف بموضع الاتزان.
موضع الاتزان: حالة الاتزان التي تكون عندها نسبة المواد الناتجة أكبر من المواد المتفاعلة، ويكون الاتزان مزاحاً جهة المواد الناتجة، أو تكون نسبة المواد المتفاعلة أكبر من المواد الناتجة، ويكون الاتزان مزاحاً نحو المواد المتفاعلة.
التحكم بموضع الاتزان
يمكن التحكم بموضع الاتزان بإزاحته نحو النواتج أو نحو المتفاعلات بالتحكم بمجموعة عوامل، مثل: التركيز، الضغط، درجة الحرارة، وقد درس تأثير تلك العوامل على موضع الاتزان العالم الفرنسي هنري لوتشاتلييه.
مبدأ لوتشاتلييه: مبدأ ينص على أن "أي تغيير في أحد العوامل المؤثرة في الاتزان لتفاعل كيميائي متزن يدفع التفاعل إلى تعديل موضع الاتزان للتقليل من أثر ذلك التغيير".
أولاً: التركيز
تغيير تركيز إحدى المواد المتفاعلة، أو إحدى المواد الناتجة سيدفع الاتزان نحو الجهة ذات التركيز الأقل ليصل الاتزان إلى موضع اتزان جديد.
مثال (1):
لديك التفاعل المتزن الآتي:
A (g) B (g) + C (g)
- زيادة تركيز A يؤدي إلى حدوث نقص في تراكيز النواتج فيدفع الاتزان نحو النواتج فتزداد سرعة التفاعل الأمامي لتعويض النقص في تركيز النواتج.
- زيادة تركيز B أو C يؤدي إلى حدوث نقص في تراكيز المتفاعلات، فيدفع الاتزان نحو المتفاعلات فتزداد سرعة التفاعل العكسي لتعويض النقص في تركيز المتفاعلات.
- سحب A من وعاء التفاعل يؤدي إلى حدوث نقص في تراكيز المتفاعلات، فيدفع الاتزان نحو المتفاعلات فتزداد سرعة التفاعل العكسي لتعويض النقص في تركيز المتفاعلات.
- سحب B أو C من وعاء التفاعل يؤدي إلى حدوث نقص في تراكيز النواتج، فيدفع الاتزان نحو النواتج، فتزداد سرعة التفاعل الأمامي لتعويض النقص في تركيز النواتج.
مثال (2):
وضح ما يحدث لتركيز غاز الكلور Cl2 إذا زاد تركيز غاز الأكسجين O2 في المعادلة الآتية:
4HCl (g) + O2 (g) 2Cl2 (g) + 2H2O (g)
الحل:
عند زيادة تركيز O2 يندفع الاتزان نحو النواتج لتعويض النقص فتزداد سرعة التفاعل الأمامي ويتكون مزيد من Cl2 .
مثال (3):
يتفكك خماسي كلوريد الفسفور PCl5 في وعاء مغلق، وينتج ثلاثي كلوريد الفسفور PCl3 وغاز الكلور Cl2 ، ويصل التفاعل إلى حالة الاتزان كما في المعادلة الآتية:
PCl5 (g) PCl3 (g) + Cl2 (g)
أوضح التغيرات التي تحدث لتراكيز المواد في وعاء التفاعل في حالة إضافة كمية من غاز Cl2 إلى وعاء التفاعل.
الحل:
عند إضافة كمية من غاز Cl2 إلى وعاء التفاعل فإن تركيزه يزداد، فتزداد سرعة التفاعل العكسي للتقليل من أثر هذه الزيادة، ويزاح موضع الاتزان جهة اليسار، فيتكون مزيد من غاز PCl5 .
ثانياً: الضغط
تغيير الضغط المؤثر على تفاعل غازي يؤدي إلى تغيير موضع الاتزان نحو الجهة التي تحتوي غازات ذات الحجم الأقل (عدد أقل من مولات الغازات)، لأن الضغط يتناسب عكسياً مع الحجم.
مثال (1):
لديك التفاعل المتزن الغازي الآتي:
2A (g) 3B (g) + C (g)
زيادة الضغط على وعاء التفاعل يؤدي إلى انزياح الاتزان نحو المتفاعلات؛ لأن عدد مولات الغاز A (2 mol)، بينما مجموع عدد مولات الغازين B و C (4 mol)، وزيادة الضغط يدفع الاتزان نحو الحجم الأقل (عدد المولات الأقل).
مثال (2):
بين أثر انخفاض الضغط في موضع الاتزان في التفاعل الآتي:
2NOCl (g) 2NO (g) + Cl2 (g)
الحل:
يتجه الاتزان نحو الحجم الأعلى (عدد المولات الأعلى) أي نحو النواتج، وذلك بزيادة سرعة التفاعل الأمامي.
مثال (3):
يحضر غاز الميثان CH4 صناعياً بتفاعل غاز أول أكسيد الكربون CO مع غاز الهيدروجين H2 كما في التفاعل المتزن الآتي:
CO (g) + 3H2 (g) CH4 (g) + H2O (g)
كيف يمكن زيادة كمية غاز الميثان، بزيادة الضغط على وعاء التفاعل أم تخفيضه؟
الحل:
نلاحظ أن مجموع عدد مولات الغازات في النواتج يساوي (2 mol)، ومجموع عدد مولات الغازات في المتفاعلات يساوي (4 mol)، لذا فعند زيادة الضغط سيندفع الاتزان نحو الحجم الأقل؛ أي عدد المولات الأقل، أي نحو النواتج فتزداد سرعة التفاعل الأمامي، وتزداد كمية غاز الميثان في وعاء التفاعل.
ثالثاً: درجة الحرارة
يختلف تأثير درجة الحرارة على النظام المتزن باختلاف نوع التفاعل؛ ماص أم طارد للحرارة.
- زيادة درجة الحرارة على التفاعل الماص للحرارة يدفع الاتزان نحو النواتج.
- زيادة درجة الحرارة على التفاعل الطارد للحرارة يدفع الاتزان نحو المتفاعلات.
مثال (1):
لديك التفاعل المتزن الآتي:
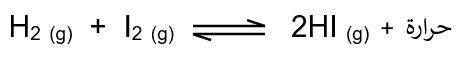
ما أثر رفع درجة الحرارة على موضع الاتزان؟
الحل:
التفاعل طارد للطاقة، لذا فإن رفع درجة الحرارة يؤدي إلى انزياح الاتزان نحو المتفاعلات وذلك بزيادة سرعة التفاعل العكسي.
مثال (2):
يتحلل رباعي أكسيد ثنائي النيتروجين N2O4 كما في المعادلة الآتية:
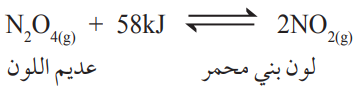
ما أثر كل من تسخين وعاء التفاعل وتبريده على موضع الاتزان؟
الحل:
التفاعل ماص للطاقة، لذا فإن رفع درجة الحرارة يؤدي إلى انزياح الاتزان نحو النواتج وذلك بزيادة سرعة التفاعل الأمامي، فيتكون مزيد من NO2 فتزداد شدة اللون البني المحمر، وتثبت بعد مدة عندما يصل التفاعل إلى حالة الاتزان من جديد، أما عند تبريد التفاعل ينزاح الاتزان نحو المتفاعلات وذلك بزيادة سرعة التفاعل العكسي، فتقل شدة اللون البني المحمر وتثبت بعد مدة عندما يصل التفاعل إلى حالة الاتزان من جديد.