 |
نصف القطر الأيوني
مقارنة نصف قطر ذرة مع أيونها
انظر إلى نموذج الكرات التالي الذي يبين حجوم ذرات عناصر ممثلة مع حجوم أيوناتها:
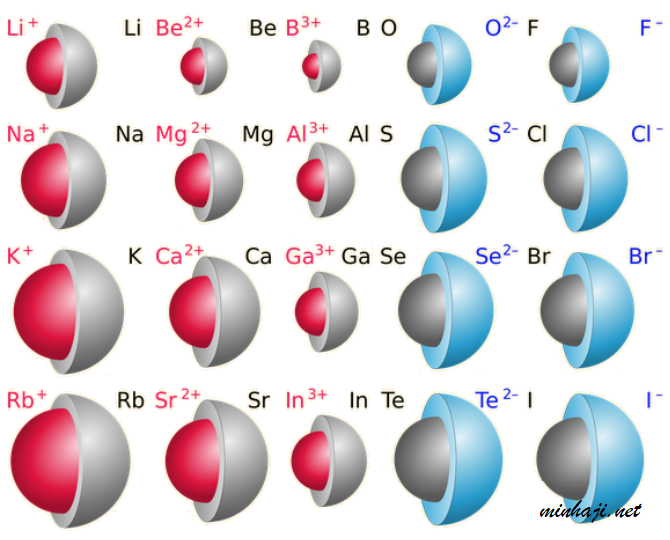
لاحظ من الشكل السابق أن:
- حجم الذرة المتعادلة أكبر من حجم أيونها الموجب.
- حجم الأيون السالب أكبر من حجم ذرته المتعادلة.
ويفسر ذلك على النحو التالي:
- حجم الذرة أكبر من حجم أيونها الموجب لأن رقم الغلاف الرئيس في الأيون الموجب أقل من رقم مستوى الطاقة الرئيس في الذرة المتعادلة.
- حجم الأيون السالب أكبر من حجم ذرته المتعادلة لأن إدخال إلكترون إلى الغلاف الرئيس الأخير يزيد من التنافر بين الإلكترونات، فيزداد الحجم.
ملاحظة:
لا يتغير العدد الذري للعنصر (عدد بروتوناته) عندما يفقد أو يكسب إلكتروناً أو أكثر.
سؤال:
أيهما أكبر حجماً:
- ذرة المغنيسيوم (ع.ذ = 12) أم أيونها الثنائي الموجب Mg2+ . لماذا؟
- ذرة النتروجين (ع.ذ = 7) أم أيونها الثلاثي السالب N3- . لماذا؟
الحل:
1-
12Mg: 1s22s22p6 3s2
12Mg2+: 1s2 2s22p6
أيون المغنيسيوم أصغر حجماً، لأن الإلكترونات الخارجية موجودة في الغلاف الرئيس الثاني الأقرب للنواة من الغلاف الرئيس الثالث الذي توجد فيه إلكترونات ذرة المغنيسيوم المتعادلة.
2-
7N: 1s22s22p3
7N3-: 1s22s22p6
أيون النتروجين أكبر حجماً من ذرته المتعادلة لأن إضافة ثلاثة إلكترونات إلى الغلاف الرئيس الثاني يؤدي إلى زيادة قوة التنافر بين الإلكترونات فيزداد الحجم.
سؤال:
في كل زوج من الأزواج الآتية، بين أيهما أكبر حجماً:
- Al أم Al3+ (ع.ذ Al = 13) .
- O أم O2- (ع.ذ O = 8) .
مقارنة حجوم أيوني ذرتين مختلفتين
لمقارنة حجوم أيونات لعناصر مختلفة نستخدم العوامل المستخدمة لمقارنة حجوم ذرات متعادلة، وهي:
- عدد الكم الرئيس (n):
زيادة قيمة (n) تعمل على زيادة حجم الذرة أو الأيون.
- شحنة النواة الفاعلة.
بزيادة شحنة النواة الفاعلة يزداد الحجم.
مثال:
أيهما أكبر حجماً: أيون الألمنيوم الثلاثي الموجب (العدد الذري للألمنيوم = 13) أم أيون الفلور الأحادي السالب (العدد الذري للفلور = 9)؟ فسر إجابتك.
الحل:
13Al3+: 1s22s22p6
9F-: 1s2 2s22p6
الإلكترونات الأخيرة في كلا الأيونين موجودة في الغلاف الرئيس الثاني (n=2) أي أن قيمة (n) متشابهه في كلا الأيونين، إلا أن شحنة النواة الفاعلة في أيون الألمنيوم أكبر من شحنة النواة الفاعلة في أيون الفلور، فالإلكترونات الأخيرة في أيون الألمنيوم منجذبة إلى (13) بروتون، بينما تنجذب الإلكترونات الأخيرة لأيون الفلور إلى (9) بروتونات، لذا يكون حجم أيون الألمنيوم أصغر.