 |
تنافر أزواج إلكترونات مستوى التكافؤ
Valence Shell Electrons Pair Repulsion (VSEPR)
اقترح الكيميائيون نظرية تسمى اختصاراً (VSEPR)، ويمكن من خلالها التنبؤ بأشكال الجزيئات؛ فهي تفترض أن أزواج إلكترونات التكافؤ تترتب حول كل ذرة بحيث تكون أبعد ما يمكن ليكون التنافر فيما بينها أقل ما يمكن، فيصبح الجزيء أكثر استقراراً.
تفترض النظرية وجود (7) أشكال أساسية للجزيئات التساهمية اعتماداً على عدد أزواج الإلكترونات الرابطة وغير الرابطة، والجدول التالي يوضح تلك الأشكال:
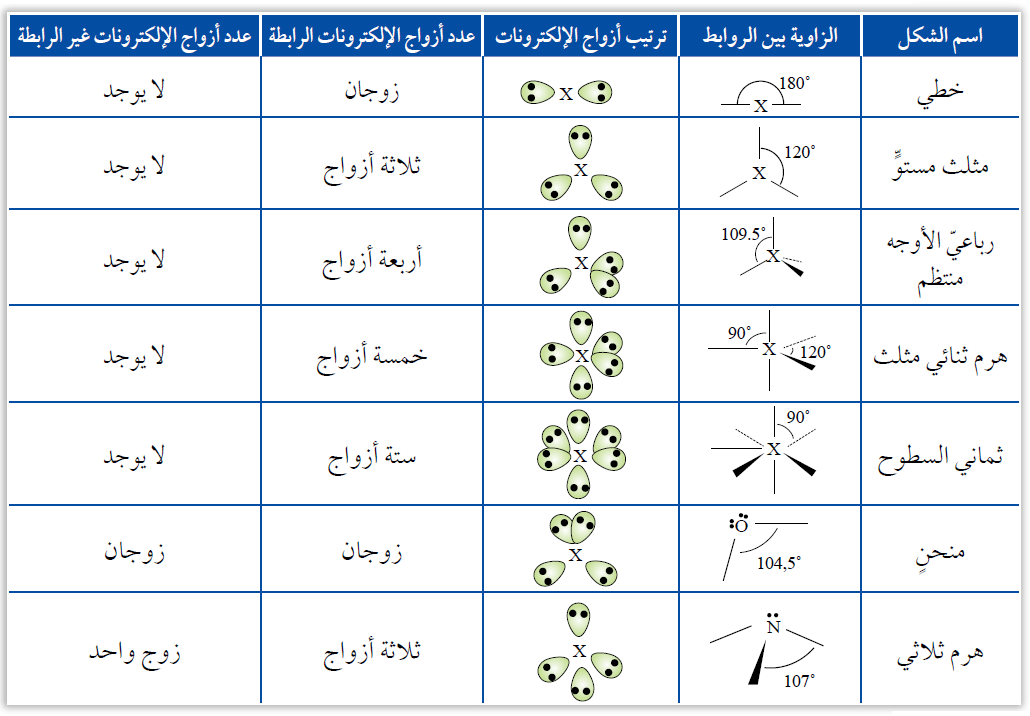
أشكال الجزيئات:
أولاً: خطي
يكون شكل الجزيء خطي إذا ارتبطت الذرة المركزية بزوجين رابطين من الإلكترونات، وتكون قيمة الزاوية بين الروابط 180o .
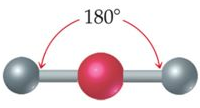
مثال:
جزيء BeH2
4Be: 1s2 2s2
يشير التوزيع الإلكتروني لذرة البريليوم أن مستوى التكافؤ يحتوي على إلكترونين، لذا فهي تشارك بهما مع ذرتي هيدروجين لتكوين رابطتين تساهميتين، فيكون شكل الجزيء خطي.

ثانياً: منحنٍ
يكون شكل الجزيء منحنٍ إذا ارتبطت الذرة المركزية بزوجين رابطين من الإلكترونات، مع وجود زوجين غير رابطين على الذرة المركزية، وهذان الزوجان من الإلكترونات يقللان قيمة الزاوية بين الروابط إلى 104.50 .
مثال:
جزيء H2O
8O: 1s2 2s2 2p4
يشير التوزيع الإلكتروني لذرة الأكسجين أن مستوى التكافؤ يحتوي على (6) إلكترونات، لذا فهي تشارك مع ذرتي هيدروجين بإلكترونين لتكوين رابطتين تساهميتين، ويتبقى زوجين غير رابطين من الإلكترونات يتنافران مع الأزواج الرابطة فتصبح قيمة الزاوية 104.50 .
ثالثاً: مثلث مستوٍ
يكون شكل الجزيء مثلث مستوٍ إذا ارتبطت الذرة المركزية بثلاثة أزواج رابطة من الإلكترونات، وتكون قيمة الزاوية بين الروابط 120o .
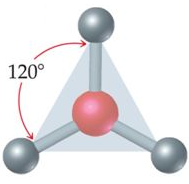
مثال:
جزيء BH3
5B: 1s2 2s2 2p1
يشير التوزيع الإلكتروني لذرة البورون أن مستوى التكافؤ يحتوي على (3) إلكترونات، لذا فهي تشارك بها مع (3) ذرات هيدروجين لتكوين (3) روابط تساهمية، فيكون شكل الجزيء مثلث مستو.
رابعاً: هرم ثلاثي
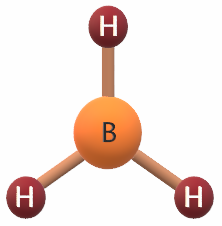
يكون شكل الجزيء هرماً ثلاثياً إذا ارتبطت الذرة المركزية بثلاثة أزواج رابطة من الإلكترونات، مع وجود زوج غير رابط من الإلكترونات على الذرة المركزية، وهذا الزوج من الإلكترونات يقلل قيمة الزاوية بين الروابط إلى 1070 .
مثال:
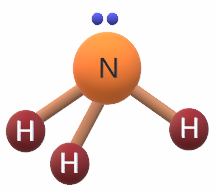
جزيء NH3
7N: 1s2 2s2 2p3
يشير التوزيع الإلكتروني لذرة النيتروجين أن مستوى التكافؤ يحتوي على (5) إلكترونات، لذا فهي تشارك مع ثلاث ذرات من الهيدروجين بثلاث إلكترونات لتكوين (3) روابط تساهمية، ويتبقى زوج غير رابط من الإلكترونات يتنافر مع الأزواج الرابطة فتصبح قيمة الزاوية 1070 .
خامساً: رباعي الأوجه منتظم
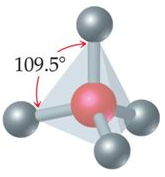
يكون شكل الجزيء رباعي الأوجه منتظم إذا ارتبطت الذرة المركزية بأربعة أزواج من الإلكترونات الرابطة، وتكون قيمة الزاوية بين الروابط 109.5o .
مثال:
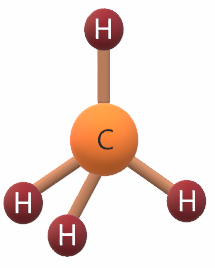
جزيء الميثان CH4
6C: 1s2 2s2 2p2
يشير التوزيع الإلكتروني لذرة الكربون أن مستوى التكافؤ يحتوي على (4) إلكترونات، لذا فهي تشارك بها مع (4) ذرات هيدروجين لتكوين (4) روابط تساهمية، فيكون شكل الجزيء رباعي الأوجه منتظم.
سادساً: هرم ثنائي مثلث
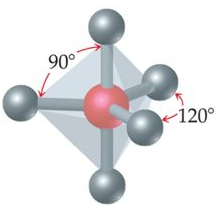
يكون شكل الجزيء هرم ثنائي مثلث إذا ارتبطت الذرة المركزية بخمسة أزواج من الإلكترونات الرابطة، وتكون قيمة الزاوية بين الروابط 90o و 120o.
مثال:
جزيء IF5
يكون اليود في هذا الجزيء (5) روابط تساهمية، فيكون شكل الجزيء هرم ثنائي مثلث.
سادساً: هرم ثماني السطوح
يكون شكل الجزيء هرم ثماني السطوح إذا ارتبطت الذرة المركزية بستة أزواج من الإلكترونات الرابطة، وتكون قيمة الزاوية بين الروابط 90o.
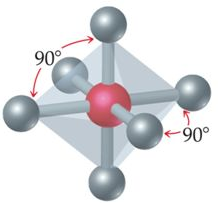
مثال:
جزيء SF6
16S: 1s2 2s2 2p3 3s2 3p4
يشير التوزيع الإلكتروني لذرة الكبريت أن مستوى التكافؤ يحتوي على (6) إلكترونات، لذا فهي تشارك بـ (6) إلكترونات مع (6) ذرات فلور لتكوين (6) روابط تساهمية، فيكون شكل الجزيء هرم ثماني السطوح.