 |
الأحماض
مفهوم الأحماض
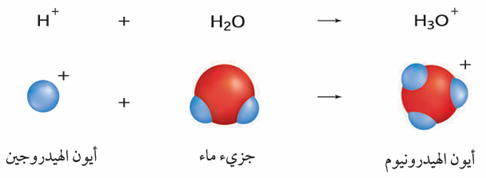
الأحماض: مواد تطلق أيونات الهيدروجين الموجبة (H+) في الماء.
يتحد أيون الهيدروجين الناتج من تفكك الحمض في الماء مع جزيء ماء لتكوين أيون الهيدرونيوم.
خصائص المحاليل الحمضية
- طعمها لاذع.
- العديد من الأحماض تسبب حروقًا لأنسجة الجسم.
- العديد من الأحماض كاوية يمكنها إلحاق الضرر بالعديد من المواد، وتسبب تآكل الأقمشة والجلد والورق وغيرها.
- محاليل الأحماض موصلة للكهرباء.
- تتفاعل محاليل بعض الأحماض بشدة مع أنواع من الفلزات، وينتج غاز الهيدروجين.
استخدامات الأحماض
- يحتوي الخل المستخدم في الطعام على حمض الخليك (الأستيك).
- تحتوي الحمضيات – ومنها البرتقال والليمون - على حمض الستريك.
- يحقن النمل ضحيته عند لسعها بحمض الفورميك (النمليك).
- يستعمل حمض الكبريتيك (H2SO4) في صناعة الأسمدة والفولاذ والطلاء والبلاستيك.
- تستعمل الأحماض في البطاريات، ويطلق عليها أحيانًا البطاريات الحمضية.
- يستعمل حمض الهيدروكلوريك (HCl) في تنظيف الشوائب عن أسطح الأدوات الفلزية.
- يستعمل حمض النيتريك (HNO3) في صناعة الأسمدة والبلاستيك والأصباغ.
الحمض في البيئة
يلعب حمض الكربونيك (H2CO3) دورًا في تشكيل الهوابط والصواعد في الكهوف.
خطوات تشكل الهوابط والصواعد في الكهوف

- عندما يذوب غاز ثاني أكسيد الكربون في الماء يتكوّن حمض الكربونيك.
- يذيب هذا المحلول الحمضي كربونات الكالسيوم (CaCO3) المكونة لصخور الكهوف الجيرية.
- عندما يسقط المحلول الحمضي من سطح كهف على الأرض يتبخر الماء ويترسب الحجر الجيري، وتتشكل الصواعد والهوابط.