مفهوم لويس للحموض والقواعد
الحمض: مادة تستطيع أن تتقبل زوجاً أو أكثر من الإلكترونات غير الرابطة من مادة أخرى لاحتوائها على أفلاك فارغة.
يجب أن يحتوي الحمض على أفلاك فارغة حسب تعريف لويس ولا يشترط توفر الهيدروجين.
القاعدة: مادة تمنح زوجاً أو أكثر من الإلكترونات غير الرابطة لمادةٍ أخرى.
يجب أن تحتوي القاعدة على أزواج من الإلكترونات غير الرابطة، وعند منح القاعدة لزوج الإلكترونات غير الرابطة تنشأ رابطة تساهمية تناسقية بين الحمض والقاعدة.
مثال (1):
يُعد HCl حمضاً حسب تعريف برونستد - لوري لأن له القدرة على منح بروتون لمادة أخرى مثل الماء، والماء يسلك سلوك القاعدة لأن له القدرة على استقبال بروتون من الحمض.

ويُعد HCl حمضاً حسب تعريف لويس لامتلاكه فلكاً فارغاً يستطيع أن يتقبل زوجاً غير رابط من الإلكترونات من مادة أخرى كالماء، والماء قاعدة لامتلاكها أزواجاً غير رابطة من الإلكترونات تستطيع أن تمنحها للحمض.
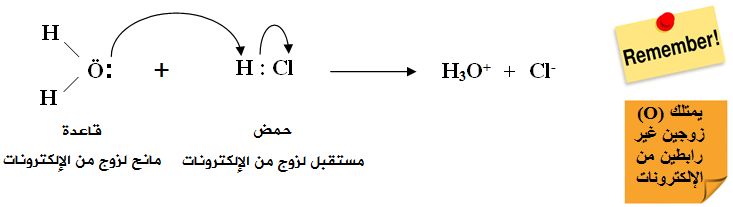
لاحظ أن ناتج معادلتي برونستد - لوري ولويس متماثل.
مثال (2):
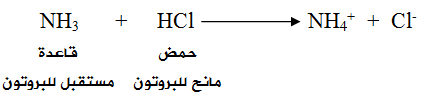
تُعد NH3 قاعدةً حسب تعريف برونستد - لوري لأن لها القدرة على استقبال بروتون من مادة أخرى كحمض HCl ، ويسلك HCl سلوك الحمض لأن له القدرة على منح بروتون للقاعدة.
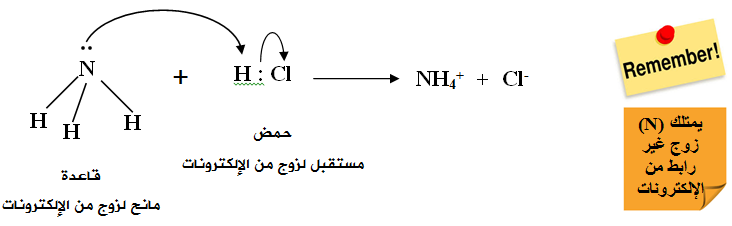
تُعد NH3 قاعدةً حسب تعريف لويس لاحتوائها على زوج غير رابط من الإلكترونات تستطيع أن تمنحه للحمض HCl ، الذي يحتوي على فلك فارغ.
أهمية تعريف لويس:
يعتمد مفهوم برونستد - لوري على انتقال البروتون من الحمض إلى القاعدة، إلا أن هناك العديد من التفاعلات التي تحدث بين المواد التي يمكن النظر إليها كتفاعلات حموض وقواعد، دون أن يرافق ذلك انتقال للبروتون، ومن ذلك تفسير السلوك الحمضي لأيونات الفلزات الانتقالية.
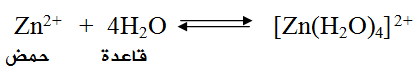
فمثلاً يعتبر أيون Zn2+ حمضاً لاحتوائه على أفلاك فارغة تستطيع أن تستقبل أزواجاً غير رابطة من الإلكترونات من مادة أخرى كالماء، كما في التفاعل:
خذ بعين الاعتبار أن لويس لم يفسر قواعد جديدة غير التي فسرها تعريف برونستد - لوري.
سؤال (1):
حدد حمض لويس وقاعدته في التفاعلات الآتية:
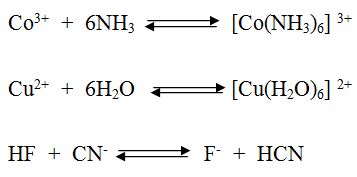
سؤال (2):
حدد حمض وقاعدة لويس في الأيون: [Ag(NH3)2] +
سؤال (3):
ادرس الجدول الآتي ثم أجب عن الأسئلة التي تليه:
|
Ni2+ |
HCO3- |
HCOO- |
|
NH3 |
F- |
NH4+ |
(أ) اختر من الجدول مثالاً واحداً على كلّ من:
1- مادة تسلك سلوكاً أمفوتيرياً.
2- مركب قاعدي لا يفسره تعريف أرهينيوس.
3- حمض لويس فقط.
(ب) اكتب معادلة تفاعل HCO3- مع F- .
(ج) اكتب معادلة تفاعل NH4+ مع HCOO- ثم حدد الزوجين المترافقين من الحمض والقاعدة.
(د) اكتب معادلة تفاعل HCO3- كقاعدة في الماء.
(هـ) فسّر سلوك الأمونيا NH3 كقاعدة حسب تعريف لويس.
(و) اختر من الجدول المادتان اللتان تشكلان معاً زوجاً مترافقاً.
سؤال (4):
أكمل الفراغات في الجدول الآتي، والذي يقارن بين مفاهيم الحموض والقواعد لكل من أرهينيوس وبرونستد - لوري ولويس:
|
التعريف |
الحمض |
القاعدة |
|
أرهينيوس |
يزيد تركيز H+ عند إذابته في الماء |
|
|
|
|
مستقبل لبروتون (H+) في تفاعلاته |
|
|
مستقبل لزوج من الإلكترونات غير الرابطة |
|
سؤال (5) : أسئلة موضوعية وزارية
1- المادة التي تسلك سلوكاً حمضياً وفق مفهوم لويس:
أ) Cl- ب) OH- ج) Zn2+ د) NH3
2- المادة التي تعد من حموض لويس من المواد الآتية هي:
أ) H2O ب) Mn2+ ج) OH- د) NH3
3- إحدى المواد الآتية تسلك كحمض لويس فقط:
أ) NH3 ب) Ni2+ ج) OH- د) H2O
4- أحد الآتية يعدّ قاعدة لويس:
أ) NH3 ب) HCl ج) Ni2+ د) Cd2+
5- الأيون الذي يعتبر قاعدة حسب تعريف لويس هو:
أ) I- ب) Cd2+ ج) Ag+ د) NH4+
6- المادة التي تسلك كحمض وفق مفهوم لويس فقط هي:
أ) NH4+ ب) HCl ج) Cd2+ د) HCOOH
7- قاعدة لويس فيما يلي هي:
أ) Fe2+ ب) NCl3 ج) NH4+ د) Fe3+
إعداد : أ. أحمد الحسين
13 / 07 / 2020
النقاشات