مراجعة الدرس الأول
1- الفكرة الرئيسة: تفاعلا التأكسد والاختزال متلازمان، يحدثان دائماً معاً ، أفسر ذلك.
2- أوضح المقصود بكل من:
أ. عدد التأكسد ب- التأكسد والاختزال الذاتي
3- أحسب عدد تأكسد العنصر الذي تحته خط:
BaO2 , H2PO4- , LiAlH4 , K2SnO2 , NaBiO3 , N2O4
4- أطبق. أحدد العناصر التي تأكسدت والعناصر التي اختزلت في التفاعلات الآتية:
1- 2HNO3 (aq) + 6HI (aq) → 2NO (g) + 3I2 (aq) + 4H2O (l)
2- 2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g)
5- أطبق. أدرس المعادلة الموزونة التي تمثل تفاعل N2O4 مع N2H4 لتكوين غاز N2 وبخار الماء، ثم أجيب عن الأسئلة الآتية:
N2O4 (l) + 2N2H4 (l) → 3N2 (g) + 4H2O (g)
أ) أحدد التغير في أعداد تأكسد ذرات النيتروجين في التفاعل.
ب) هل تمثل المعادلة تفاعل تأكسد واختزال ذاتي؟
ج) أحدد العامل المؤكسد والعامل المختزل في التفاعل.
6- أحدد المادة التي يمكن أن تسلك كعامل مؤكسد والمادة التي يمكن أن تسلك كعامل مختزل:
H+ , Br- , Na+ , F2 , H- , Cu
7- أحدد العامل المؤكسد والعامل المختزل في التفاعل الآتي:
6Fe2+ (aq) + Cr2O72- (aq) + 14H+ (aq) → 6Fe3+ (aq) + 2Cr3+ (aq) + 7H2O (l)
8- أطبق. أوازن أنصاف التفاعلات الآتية بطريقة نصف التفاعل، وأحدد ما إذا كانت المادة تمثل عاملاً مؤكسداً أم عاملاً مختزلاً:

9- أطبق. أوازن معادلات التأكسد والاختزال الآتية بطريقة نصف التفاعل، وأحدد العامل المؤكسد والعامل المختزل في كل منها:
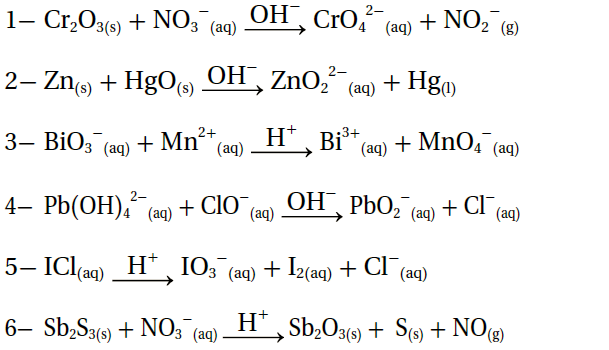
إعداد : شبكة منهاجي التعليمية
31 / 01 / 2023
النقاشات