كيمياء الخلايا الجلفانية
Chemistry of Galvanic Cells
تتكون الخلية الجلفانية من نصفين، كل نصف يتكون من وعاء يحتوي على صفيحة فلزية مغموسة في محلول يحتوي على أيونات الفلز، مثل كبريتات الفلز.
يتم توصيل الأقطاب الفلزية بموصل خارجي (أسلاك) يعمل على نقل الإلكترونات، ويتم توصيل المحاليل في الوعائين بموصل آخر هو القنطرة الملحية يعمل على نقل الأيونات الموجبة والسالبة.
أولاً: قطبا الخلية
أ- المصعد Anode (-):
وهو القطب الذي تحدث عنده عملية التأكسد (يحدث التأكسد للقطب نفسه)، ويكتسب شحنة سالبة لأنه مصدر الإلكترونات بسبب تأكسد ذراته.
ب- المهبط Cathode (+):
وهو القطب الذي تحدث عنده عملية الاختزال (يحدث الاختزال على أيوناته الموجبة الموجودة في المحلول)، ويكتسب شحنة موجبة نتيجة سريان إلكترونات نحوه في الدارة الخارجية.
ثانياً: دارة خارجية
وتتكون من سلك فلزي يعمل على نقل الإلكترونات من المصعد إلى المهبط، ويمكن وصله بفولتميتر لقياس فرق الجهد بين قطبي الخلية، ولبيان اتجاه الإلكترونات (مؤشر الفولتميتر يتجه إلى جهة قطب المهبط).
ثالثاً: قنطرة ملحية
وهي أنبوب على شكل حرف (U) يحتوي على محلول ملحي مشبع، لا تتفاعل أيوناته مع الأيونات الموجودة في نصفي الخلية الجلفانية أو مع الأقطاب، مثل KCl ، وتعمل القنطرة الملحية على حفظ التوازن الكهربائي؛ فهي تعادل الشحنات الكهربائية في نصفي الخلية الجلفانية.
مبدأ عمل الخلية الجلفانية
مثال (1):
تمثل المعادلة التالية التفاعل الذي يحدث في خلية غلفانية قطباها (خارصين - نحاس):
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
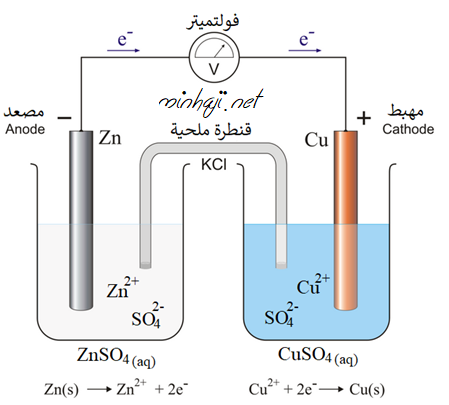
تتكون الخلية من وعائين:
الوعاء الأول: يحتوي على قطب خارصين مغموس في محلول كبريتات الخارصين ZnSO4، ويُسمى نصف خلية الخارصين، ويعبر عنه بالرمز (Zn2+│Zn).
الوعاء الثاني: يحتوي على قطب نحاس مغموس في محلول كبريتات النحاس CuSO4، ويُسمى نصف خلية النحاس، ويعبر عنه بالرمز (Cu2+│Cu).
يتصل القطبان معاً بأسلاك فلزية موصولة بفولتميتر.
يتصل المحلولان معاً بقنطرة ملحية.
ماذا يحدث في نصف خلية الخارصين؟
يلاحظ من المعادلة أن الخارصين قد تأكسد، لذا فهو يمثل المصعد في هذه الخلية، وإشارة قطبه سالبة، ويتأكسد القطب كما في المعادلة:
نصف تفاعل التأكسد/المصعد Zn (s) → Zn2+ (aq) + 2e-
تتجه الإلكترونات الناتجة من تأكسد القطب عبر الأسلاك مروراً بالفولتميتر فينحرف المؤشر نحو قطب النحاس.
بفعل تأكسد الخارصين يتحول إلى أيونات Zn2+ فتقل كتلة القطب، ويزداد تركيز أيونات Zn2+ ، فيصبح تركيزها أعلى من تركيز أيونات الكبريتات السالبة في المحلول.
ماذا يحدث في نصف خلية النحاس؟
يلاحظ من المعادلة أن أيونات النحاس قد اختزلت، لذا فقطب النحاس يمثل المهبط في هذه الخلية، وإشارة قطبه موجبة، وتُختزل أيونات النحاس بفعل الإلكترونات القادمة من قطب الخارصين كما في المعادلة:
نصف تفاعل الاختزال/المهبط Cu2+ (aq) + 2e- → Cu (s)
بفعل اختزال أيونات النحاس Cu2+ تتحول إلى ذرات نحاس تتجمع على قطب النحاس، فتزداد كتلة القطب، ويقل تركيز أيونات Cu2+ ، فيصبح تركيزها أقل من تركيز أيونات الكبريتات السالبة في المحلول.
ويأتي دور القنطرة الملحية فتعمل على حفظ التوازن الكهربائي، حيث تتحرك أيونات الكلوريد السالبة Cl- من القنطرة الملحية إلى نصف خلية الخارصين لمعادلة الزيادة في تركيز أيونات Zn2+ ، وتتحرك أيونات K+ الموجبة إلى نصف خلية النحاس لمعادلة أيونات SO42- الزائدة.
التعبير عن الخلية الجلفانية بطريقة مختصرة:
- تكتب مكونات نصف خلية التأكسد من اليسار، وتكتب المادة التي تأكسدت أولاً ثم ناتج عملية التأكسد.
- يرسم خطان متوازيان يمثلان القنطرة الملحية.
- تكتب مكونات نصف خلية الاختزال على اليمين، وتكتب المادة التي اختزلت أولاً ثم ناتج عملية الاختزال.

مثال (2):
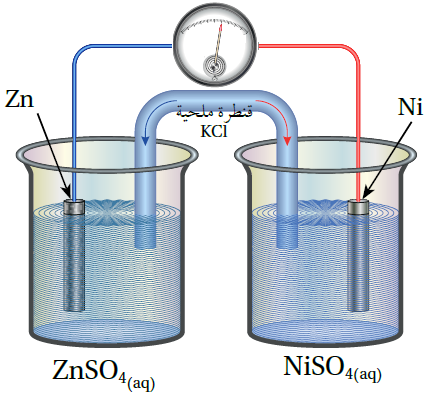 أدرس الشكل المجاور، الذي يمثل خلية جلفانية مكونة من نصف خلية الخارصين Zn2+│Zn ونصف خلية النيكل Ni2+│Ni ، ثم أجيب عن الأسئلة الآتية:
أدرس الشكل المجاور، الذي يمثل خلية جلفانية مكونة من نصف خلية الخارصين Zn2+│Zn ونصف خلية النيكل Ni2+│Ni ، ثم أجيب عن الأسئلة الآتية:
1- أحدد كلاً من المصعد والمهبط في الخلية.
2- أحدد اتجاه حركة الإلكترونات عبر الأسلاك.
3- أكتب نصفي تفاعل التأكسد والاختزال.
4- أحدد اتجاه حركة الأيونات الموجبة والسالبة عبر القنطرة الملحية.
5- ما التغير في كتلة كل من قطبي النيكل والخارصين؟
الحل:
1- يلاحظ أن الفولتيميتر انحرف باتجاه قطب النيكل، فهو بذلك المهبط، والخارصين المصعد.
2- تتحرك الإلكترونات من قطب الخارصين إلى قطب النيكل.
3- نصف تفاعل التأكسد: Zn → Zn2+ + 2e- ، نصف تفاعل الاختزال: Ni2+ + 2e- → Ni
4- تتحرك الأيونات السالبة Cl- عبر القنطرة الملحية باتجاه نصف خلية الخارصين، وتتحرك الأيونات الموجبة K+ من القنطرة الملحية إلى نصف خلية النيكل.
5- تقل كتلة قطب الخارصين نتيجة تأكسد ذراته، وتزداد كتلة قطب النيكل نتيجة اختزال أيوناته الموجبة.
مثال (3):
تمثل المعادلة التالية التفاعل الذي يحدث في خلية جلفانية قطباها من الكادميوم والقصدير:
Sn2+(aq) + Cd(s) → Sn(s) + Cd2+(aq)
1- أي القطبين يمثل المصعد، وأيهما يمثل المهبط، وما شحنة كل منهما؟
2- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
3- أوضح اتجاه حركة الإلكترونات في الدارة الخارجية.
4- إلى أي الأقطاب يتحرك مؤشر الفولتميتر؟
5- أي القطبين ستنقص كتلته؟
6- ماذا يحدث لتركيز أيونات Cd2+ ؟
الحل:
1- بما أن عملية التأكسد قد حدثت على قطب الكادميوم Cd لذا فهو يمثل المصعد وإشارته سالبة، وبما أن عملية الاختزال قد حدثت على قطب القصدير Sn لذا فهو يمثل المهبط وإشارته موجبة.
2- نصف تفاعل التأكسد/المصعد: → Cd2+ + 2e- Cd
نصف تفاعل الاختزال/المهبط: Sn2+ + 2e- → Sn
3- تتحرك الإلكترونات في الدارة الخارجية من قطب الكادميوم (المصعد) إلى قطب القصدير (المهبط).
4- يتحرك مؤشر الفولتميتر نحو قطب القصدير (المهبط).
5- قطب الكادميوم.
6- تزداد.
سؤال (1):
تمثل المعادلة التالية التفاعل الذي يحدث في خلية (خارصين - فضه):
Zn (s) + 2Ag+ (aq) → Zn2+ (aq) + 2Ag (s)
1- أي القطبين يمثل المصعد وأيهما يمثل المهبط، وما شحنة كل منهما؟
2- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
3- أوضح اتجاه حركة الإلكترونات في الدارة الخارجية واتجاه مؤشر الفولتميتر.
4- أوضح اتجاه حركة الأيونات السالبة في القنطرة الملحية.
5- أي القطبين تقل كتلته؟
6- ماذا يحدث لتركيز أيونات Ag+ ؟
سؤال (2):
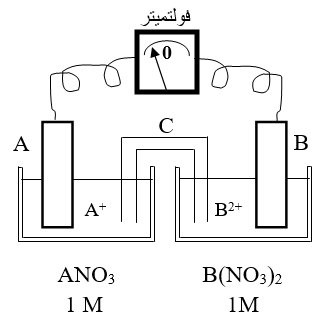 الشكل المجاور يمثل خلية جلفانية، استعن بالشكل للإجابة عن الأسئلة التالية:
الشكل المجاور يمثل خلية جلفانية، استعن بالشكل للإجابة عن الأسئلة التالية:
1- أي القطبين يمثل المصعد؟ وما شحنته؟
2- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
3- أكتب المعادلة الموزونة للتفاعل الكلي.
4- ماذا يحدث لكتلة صفيحة B مع مرور الزمن؟
5- ما الذي يمثله الرمز (C) في الخلية، وما دورها؟
6- ما تحولات الطاقة في هذه الخلية؟
7- بين اتجاه حركة الأيونات السالبة في القنطرة الملحية.
سؤال (3):
في خلية جلفانية قطباها من الفلزين (M/Q) ينحرف مؤشر الفولتميتر باتجاه قطب M ، إذا علمت أن M أيون ثنائي الشحنة في مركباته، و Q أيون ثلاثي الشحنة في مركباته، أجيب عما يلي:
1- أحدّد المصعد في الخلية.
2- أي القطبين تزداد كتلته.
3- ما شحنة قطب M ؟
4- في أي وعائي الخليتين يزداد تركيز الأيون الموجب؟
5- أكتب معادلة موزونة تمثّل التفاعل الكلي الذي يحدث في الخلية.
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات