العلاقة بين عدد المولات وسرعة استهلاك المتفاعلات وإنتاج النواتج
انظر إلى التفاعل التالي:
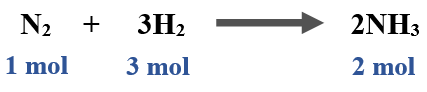
تعني المعادلة أنّ:
إنتاج (2 mol) من NH3 يتطلب استهلاك (1 mol) مول من N2 ، واستهلاك (3 mol) من H2 .
فلو أردنا مثلاً أن نجد العلاقة بين سرعة استهلاك N2 وسرعة إنتاج NH3 نقول:
سرعة إنتاج NH3 = ضعف سرعة استهلاك N2
أو
سرعة إنتاج NH3 = 2 × سرعة استهلاك N2
أو
سرعة إنتاج NH3 = سرعة استهلاك N2
أو
R = - =
وهذا يعني أنه لإيجاد العلاقة بين سرعة استهلاك أو إنتاج مادة مع سرعة استهلاك أو إنتاج مادة أخرى نضرب سرعة الاستهلاك أو الإنتاج في مقلوب المعامل من المعادلة الكيميائية الموزونة.
وعليه يمكن التعبير عن سرعة التفاعل للتفاعل السابق على النحو الآتي:
R = - = - =
سؤال 1 :
أعبر عن سرعة استهلاك المواد المتفاعلة، وسرعة تكوين المواد الناتجة بدلالة تغير تركيز كل منها في مدّة زمنية محددة؛ وفق المعادلة الموزونة الآتية:
4NH3(g) + 5O2(g) → 6H2O(g) + 4NO(g)
الحل:
R = - = - = =
سؤال 2 :
يتفاعل غاز ثاني أكسيد النيتروجين NO2 مع غاز الفلور لتكوين غاز فلوريد النتريل NO2F ؛ وفق المعادلة الموزونة الآتية:
2NO2(g) + F2(g) → 2NO2F(g)
أعبر عن العلاقة بين سرعة تكوين NO2F وسرعة استهلاك F2 ؟
الحل:
R = - =
أي أن سرعة استهلاك F2 تساوي نصف سرعة تكوين NO2F أو سرعة تكوين NO2F ضعف سرعة استهلاك F2
سؤال 3 :
أجد العلاقة بين سرعة استهلاك O2 ، وسرعة إنتاج N2O5 في المعادلة الموزونة التالية بدلالة التغير في التركيز في وحدة الزمن:
2N2 + 5O2 → 2N2O5
الحل:
R = - =
سؤال 4 :
يتحلل غاز هيدريد الفسفور PH3 ؛ وفق معادلة التفاعل الآتية:
4PH3(g) → P4(g) + 6H2(g)
أحسب سرعة استهلاك هيدريد الفسفور PH3 ؛ علماً أن سرعة تكوين غاز الهيدروجين تساوي 0.06 M/s
الحل:
R = - =
R = - = x 0.06
= 0.24 M/s
سؤال 5 :
في التفاعل الآتي: + 2H2O (g) C2H4 (g) + 3O2 (g) → 2CO2 (g) ،
إذا كانت سرعة اختفاء O2 = 0.45 M/s، فاحسب سرعة ظهور CO2 .
الحل:
R = - =
- x 0.45 =
= 0.30 M/s
سؤال 6 :
يتفكك غاز N2O4 بالحرارة مكوناً غاز NO2 وفق المعادلة الآتية:
N2O4(g) → 2NO2(g)
سجلت بيانات تغير تراكيز المادة المتفاعلة والمادة الناتجة خلال مدة زمنية كما يأتي:
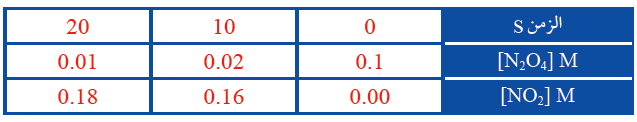
1- أحسب سرعة استهلاك O4N2 في المدة الزمنية 10 – 20 s
2- أحسب سرعة تكوّن NO2 في المدة الزمنية 10 – 20 s
الحل:
1- أقسم التغير في تركيز O4N2 على التغير في الزمن:
R = - = - = - = 0.001 M/s
2- أقسم التغير في تركيز NO2 على التغير في الزمن:
R = - = - = - = 0.002 M/s
سؤال 7 :
في التفاعل الغازي 2A → B + 3C ، وجد أن تركيز A خلال (10 s) قد تغير من (1.6 M) إلى (0.4 M). أحسب سرعة:
1- تكوين B خلال الفترة الزمنية ذاتها.
2- إنتاج C خلال الفترة الزمنية ذاتها.
سؤال 8 :
يتفاعل الهيدروجين مع اليود لتكوين يوديد الهيدروجين HI وفق المعادلة الآتية:
H2 + I2 → 2HI
ولدى دراسة تغير تركيز H2 مع الزمن أمكن الحصول على البيانات الآتية:
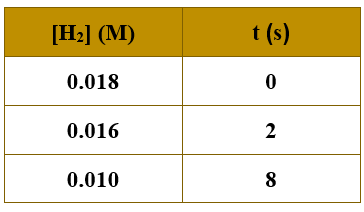
أحسب سرعة:
1- استهلاك H2 في الفترة الزمنية من (2-8 s).
2- إنتاج HI خلال الفترة الزمنية نفسها.
3- استهلاك I2 في الفترة الزمنية من (0-2 s).
سؤال 9 :
يتفكك المركب الافتراضي A2B3 بالحرارة وفقاً للمعادلة الآتية: A2B3 → 2A + 3B
أجب عن الأسئلة الآتية:
1- إذا تغير تركيز A2B3 من (0.8 M) إلى (0.2 M) خلال (3 min).
احسب سرعة استهلاك A2B3 بوحدة M/min
2- إذا كانت سرعة إنتاج A يساوي (0.4 M/min)، فما سرعة إنتاج B خلال الفترة الزمنية نفسها؟
سؤال 10 :
يتفاعل غاز الأمونيا والأكسجين حسب المعادلة التالية:
4NH3 (g) + 3O2 (g) → 2N2 (g) + 6H2O (g)
فإذا كانت سرعة إنتاج غاز النتروجين عند زمن معين يساوي 1.2 M/s ، فما سرعة:
1- إنتاج بخار الماء H2O ؟
2- استهلاك غاز الأكسجينO2 ؟
3- اختفاء غاز الأمونيا NH3 ؟
سؤال 11 :
في التفاعل التالي:
2N2O5 (g) → 4NO2 (g) + O2 (g)
إذا كان سرعة إنتاج O2 = 0.40 M/s، فما سرعة:
1- استهلاك N2O5 ؟
2- تكوين NO2؟
سؤال 12 :
إذا تغير تركيز NO2 في التفاعل:
N2O4 → 2NO2
من 0.24 M إلى 0.48 M خلال دقيقتين، فما سرعة:
1- إنتاج NO2 بوحدة M/min؟
2- تكوين NO2 بوحدة M/s؟
3- استهلاك N2O4 في الفترة الزمنية ذاتها بوحدة (M/min)؟
سؤال 13 :
أدرس التفاعل الآتي، ثم أجيب عن السؤال الذي يليه:
A + 2B → 3Z
بعد مرور (10 s) من بداية التفاعل تغيّر [B] من 0.8 M إلى 0.6 M ، أحسب [Z] بعد مرور (10 s) من بداية التفاعل.
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات