تعيين رتبة التفاعل لتفاعل يشتمل على أكثر من مادة متفاعلة
سؤال 1 :
يتفاعل ثاني أكسيد النيتروجين NO2 مع حمض الهيدروكلوريك HCl ، وفق معادلة التفاعل الآتية:
NO2(g) + 2HCl(g) → NO(g) + H2O(g) + Cl2(g)
أجريت ثلاث تجارب بتراكيز مختلفة عند درجة حرارة ثابتة؛ وجرى حساب سرعة التفاعل الابتدائية لكل تجربة، وسجلت النتائج؛ فكانت كما تظهر في الجدول الآتي:
1- أكتب قانون سرعة التفاعل العام.
قانون سرعة التفاعل العام:
R = k [NO2]x [HCl]y
2- أستنتج رتبة المادة المتفاعلةNO2 .
لتحديد رتبة التفاعل بالنسبة للمادة NO2 ؛ أقارن بين تركيز NO2 وسرعة التفاعل في التجربتين (1) و (2) عند ثبات تركيز HCl ، حيث ألاحظ أن تركيز NO2 تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة مرتين:
= 2
وعليه فإن رتبة المادة المتفاعلة NO2 هي الرتبة الأولى (1).
أو يمكن أن نقسم التجربة رقم (2) على التجربة رقم (1):
=
وباختصار قيمة ثابت السرعة k وتركيز HCl لأنهما ثابتان تصبح العلاقة:
=
=
2 = (2)x ⇒ x = 1
3- أستنتج رتبة المادة المتفاعلة HCl .
لتحديد رتبة التفاعل بالنسبة للمادة HCl ؛ أقارن بين تركيز HCl وسرعة التفاعل في التجربتين (1) و (3) عند ثبات تركيز NO2 ، حيث ألاحظ أن تركيز HCl تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة مرتين:
= 2
وعليه فإن رتبة المادة المتفاعلة HCl هي الرتبة الأولى (1).
أو يمكن أن نقسم التجربة رقم (3) على التجربة رقم (1):
=
=
=
2 = (2)y ⇒ y = 1
4- أستنتج قانون السرعة لهذا التفاعل.
قانون السرعة لهذا التفاعل:
R = k [NO2]1 [HCl]1
5- أحسب قيمة ثابت سرعة التفاعل k ، وأحدد وحدته.
لحساب قيمة ثابت السرعة k نعوّض قيم التركيز والسرعة في إحدى التجارب الواردة في الجدول، فمثلاً يمكن تعويض القيم الواردة في الجدول والخاصة بالتجربة رقم (1):
R = k [NO2]1 [HCl]1
1.4 x 10-3 = k [0.3]1 [0.3]1
k = 1.55 x 10-2 M-1.s-1
6- أحسب سرعة التفاعل عندما يكون 0.1 M = [NO2] = [HCl]
R = k [NO2]1 [HCl]1
R = 1.55 x 10-2 [0.1]1 [0.1]1
R = 1.55 x 10-4
سؤال 2 :
يتفاعل غاز أحادي أكسيد النيتروجين NO مع غاز الأكسجين O2 ، مكوناً غاز ثاني أكسيد النيتروجين NO2 ، وفق معادلة التفاعل الآتية:
2NO(g) + O2(g) → 2NO2(g)
وبقياس سرعة التفاعل الابتدائية عند تراكيز ابتدائية مختلفة من NO و O2 ؛ سجلت النتائج كما يظهر في الجدول الآتي:
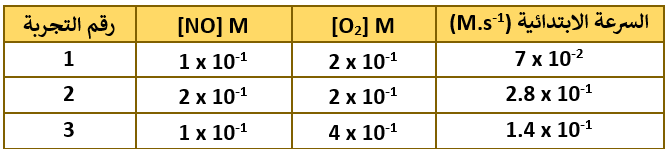
أستعين بنتائج هذه التجارب في تحديد رتبة التفاعل بالنسبة لكل من أحادي أكسيد النيتروجين والأكسجين.
الحل:
لتحديد رتبة التفاعل بالنسبة للمادة NO ؛ أقارن بين تركيز NO وسرعة التفاعل في التجربتين (1) و (2) عند ثبات تركيز O2 ، حيث ألاحظ أن تركيز NO تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة (4) مرات:
= 4
وعليه فإن رتبة المادة المتفاعلة NO هي الرتبة الثانية (2).
أو يمكن أن نقسم التجربة رقم (2) على التجربة رقم (1):
=
وباختصار قيمة ثابت السرعة k وتركيز O2 لأنهما ثابتان تصبح العلاقة:
=
=
4 = (2)x ⇒ x = 2
لتحديد رتبة التفاعل بالنسبة للمادة O2 ؛ أقارن بين تركيز O2 وسرعة التفاعل في التجربتين (1) و (3) عند ثبات تركيز NO ، حيث ألاحظ أن تركيز O2 تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة مرتين:
= 2
وعليه فإن رتبة المادة المتفاعلة O2 هي الرتبة الأولى (1).
أو يمكن أن نقسم التجربة رقم (3) على التجربة رقم (1):
=
وباختصار قيمة ثابت السرعة k وتركيز NO لأنهما ثابتان تصبح العلاقة:
=
=
2 = (2)y ⇒ y = 2
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات