قطبية الجزيئات
Polarity of Molecules
قطبية الرابطة
تكون الرابطة قطبية إذا اختلفت الذرتان في السالبية الكهربائية، بشرط أن يزيد الفرق في السالبية الكهربائية بين الذرتين عن 0.4 وفق مقياس باولنج، وبسبب هذا الفرق ينشأ عدم انتظام في الكثافة الإلكترونية، فتنزاح إلكترونات الرابطة نحو الذرة ذات السالبية الكهربائية الأعلى فتحمل شحنة جزئية سالبية، بينما تحمل الذرة الأخرى شحنة جزئية موجبة.
أمثلة:
الرابطة (Cl-Cl) غير قطبية، بينما الرابطة (H-Cl) قطبية.
قطبية الجزيء
- يكون الجزيء قطبي (يمتلك عزم قطبي) إذا كانت محصلة العزوم القطبية لروابطه لا تساوي صفر.
- يكون الجزيء غير قطبي (لا يمتلك عزم قطبي) إذا كانت محصلة العزوم القطبية لروابطه تساوي صفر.
ويقاس العزم القطبي للجزيء بوحدة الديباي (D).
أولاً: قطبية الجزيئات ثنائية الذرة
في حالة الجزيئات ثنائية الذرة يكفي أن تكون الرابطة قطبية كي يمتلك الجزي عزماً قطبياً؛ أي أن يكون الجزيء قطبياً.
أمثلة:

جزيء H2 غير قطبي؛ لأن الرابطة غير قطبية.
جزيء HF قطبي؛ لأن الرابطة قطبية.
ثانياً: قطبية الجزيئات عديدة الذرات
يتطلب معرفة قطبية الروابط، والشكل الهندسي.
أ) الجزيئات الخطية
وهي جزيئات غير قطبية إلا إذا كانت الرابطتان مختلفتان في القطبية.
أمثلة:
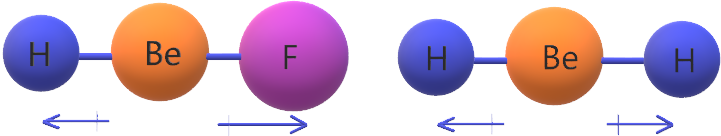
جزيء BeF2 غير قطبي؛ لأن محصلة قطبية روابطه تساوي صفر؛ لأن الرابطتين متساويتين في القطبية ومتعاكستين في الاتجاه.
جزيء BeHF قطبي؛ لأن محصلة قطبية روابطه لا تساوي صفر؛ وذلك لعدم تساوي قطبية الرابطتين.
ب) الجزيئات ذات الشكل المثلث المستوي
وهي جزيئات غير قطبية إلا إذا كانت روابطها مختلفة في القطبية.
أمثلة:
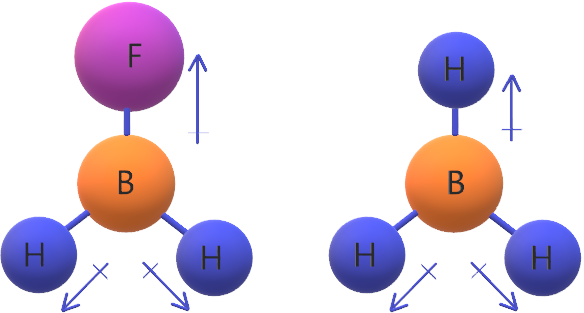
جزيء BH3 غير قطبي؛ لأن محصلة قطبية روابطه تساوي صفر.
جزيء BH2F قطبي لأن محصلة قطبية روابطه لا تساوي صفر وذلك لعدم تساوي قطبية روابطه.
ج- الجزيئات ذات الشكل الرباعي الأوجه منتظم
وهي جزيئات غير قطبية إلا إذا كانت روابطها مختلفة في القطبية.
أمثلة:
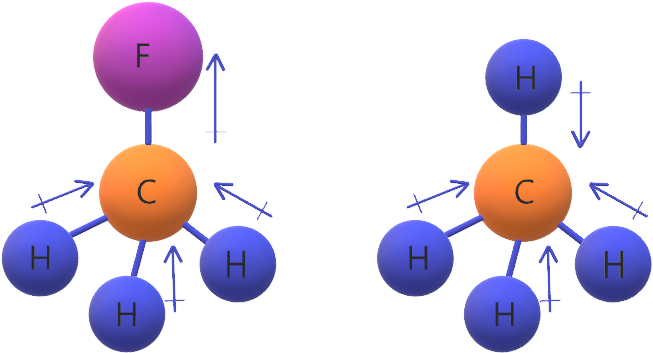
جزيء CH4 غير قطبي؛ لأن محصلة قطبية روابطه تساوي صفر.
جزيء CH3Cl قطبي؛ لأن محصلة قطبية روابطه لا تساوي صفر؛ وذلك لعدم تساوي قطبية روابطه.
د- الجزيئات ذات الشكل المنحني أو الهرمي الثلاثي
دائماً قطبية لوجود أزواج من الإلكترونات غير الرابطة في الذرة المركزية والتي تجعل محصلة قطبية الروابط لا تساوي صفر.
أمثلة:
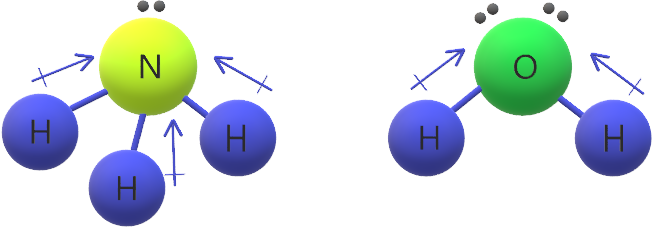
جزيء H2O وجزيء NH3 قطبيان؛ لأن محصلة قطبية الروابط في كل منهما لا تساوي صفر.
سؤال (1):
أي الجزيئات الآتية قطبية : ( استخرج الأعداد الذرية من الجدول الدوري )
CH3F , SiH4 , CO , NCl3 , F2 , HBr , BF3, SO2, HF, CO2 , PH3 , SCl2 , OF2.
الإجابة:
الجزيئات القطبية: NCl3 , CO , CH3F , HBr , SO2 , HF , PH3 , SCl2 , OF2
سؤال (2):
فسر ما يلي:
- الجزيء BeCl2 غير قطبي على الرغم من قطبية الرابطة Be – Cl.
- جزيء CCl4 غير قطبي بالرغم من قطبية الرابطة ( C–Cl ).
- على الرغم من كون الرابطتان F–B , F–N، قطبيتان إلا أن الجزيء NF3 قطبي وجزيء BF3 غير قطبي.
الإجابة:
- الجزيء BeCl2 غير قطبي لأن محصلة قطبية روابطه تساوي صفر، أما الرابطة Be–Cl فهي قطبية لأن الفرق في السالبية الكهربائية بين الذرتين لا يساوي صفر.
- الجزيء CCl4 غير قطبي لأن محصلة قطبية روابطه تساوي صفر، أما الرابطة C–Cl فهي قطبية لأن الفرق في السالبية الكهربائية بين الذرتين لا يساوي صفر.
- الرابطتان قطبيتان لأن الفرق في السالبية الكهربائية بين الذرات لا يساوي صفر، وجزيء NF3 قطبي لأن محصلة قطبيه الروابط لا تساوي صفر، والجزيء BF3 غير قطبي لأن محصلة قطبية روابطه تساوي صفر.
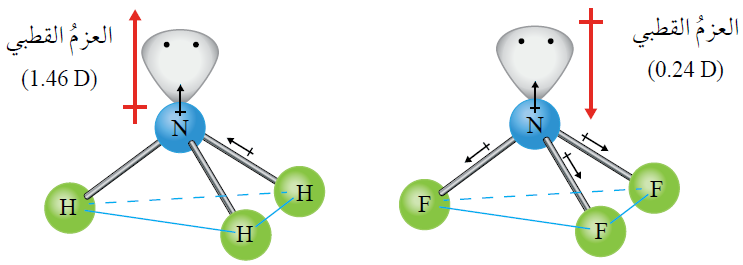
أثر أزواج الإلكترونات غير الرابطة في قطبية الجزيء
تسبب أزواج الإلكترونات غير الرابطة في تولد عزم قطبي يتجه بعيداً عن النواة، فإذا اتجاه قطبية الروابط مع اتجاه العزم القطبي للزوج غير الرابط زاد العزم القطبي للجزيء.
مثال:
العزم القطبي لجزيء (NH3) أكبر من العزم القطبي لجزيء (NF3)؛ لأن اتجاه قطبية الروابط في جزيء (NH3) مع اتجاه العزم القطبي لزوج الإلكترونات غير الرابط، بينما اتجاه قطبية الروابط في جزيء (NF3) عكس اتجاه العزم القطبي لزوج الإلكترونات غير الرابط.
إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات