عدد التأكسد
Oxidation Number
كثير من التفاعلات الكيميائية يصعب تحديد المواد التي تأكسدت وتلك التي اختزلت، لذا فقد أدخل الكيميائيون مفهوم عدد التأكسد، ويقصد به:

وقد وضع الكيميائيون قواعد لحساب عدد التأكسد للذرات نظراً لكون أعداد التأكسد للكثير من الذرات يتغير من مركب إلى آخر.
قواعد حساب عدد التأكسد
(1) عدد التأكسد للذرة في أي عنصرمنفرد (غير متحد) يساوي صفراً.
مثال:
عدد التأكسد لكل من الماغنيسيوم Mg ، والصوديوم Na ، والكلور Cl2 ، والأكسجين O2يساوي صفراً.
(2) عدد التأكسد للأيون أحادي الذرة يساوي الشحنة التي يحملها مقداراً وإشارةً.
مثال:
عدد تأكسد أيون الماغنيسيوم Mg2+ هو (2+)، وأيون الكلوريد Cl-
(3) عدد تأكسد الهيدروجين في أغلب مركباته يساوي (1+).
باستثناء هيدريدات الفلزات فهو (1-)، وهيدريدات الفلزات هي المركبات الناتجة من ارتباط الهيدروجين مع الفلزات.
مثال:
هيدريد الصوديوم NaH ، هيدريد الكالسيوم CaH2 .
(4) عدد تأكسد الأكسجين في أغلب مركباته (-2).
باستثناء فوق الأكاسيد فهو (1-) مثل فوق أكسيد الهيدروجين H2O2 ، وفوق أكسيد الصوديومNa2O2 .
ويكون عدد تأكسد الهيدروجين (2+) إذا اتحد مع الفلور في المركب OF2 ، وذلك لأن للفلور سالبية أكبر من الأكسجين.
(5) عدد التأكسد لكل عنصر من عناصر المجموعات ( 1 , 2 , 3 ) في مركباته يساوي رقم المجموعة مسبوقاً بالإشارة الموجبة.
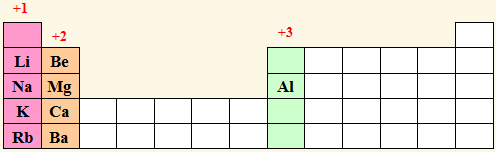
(6) عدد تأكسد الهالوجينات (المجموعة السابعة) يساوي (1-) في مركباتها، أما في مركباتها الأكسجينية فلها أعداد تأكسد موجبة تتراوح بين (1+) و (7+).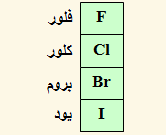
أما الفلور فيكون عدد تأكسده (1-) في جميع مركباته.
(7) مجموع أعداد التأكسد للذرات في جزيء المركب المتعادل يساوي صفراً، أي أن مجموع الشحنات السالبة والموجبة في المركب المتعادل = صفراً.
مثال:
مجموع أعداد تأكسد النيتروجين والهيدروجين والأكسجين في المركب HNO3 يساوي صفر.
(8) مجموع أعداد التأكسد للأيون عديد الذرات يساوي شحنة الأيون مقداراً وإشارةً.
مثال:
مجموع أعداد تأكسد الفسفور والأكسجين في الأيون PO43- يساوي (-3).
أمثلة على حساب أعداد التأكسد
مثال (1):
احسب عدد تأكسد الكبريت في حمض الكبريتيك H2SO4 .
الحل:
(عدد تأكسد S × عدد ذراته)
+ (عدد تأكسد O × عدد ذراته)
+ (عدد تأكسد H × عدد ذراته) = صفر
( 1 x S ) + ( 4 x 2- ) + ( 2 x 1+ ) = 0
( S ) + ( 8- ) + ( 2+ ) = 0
( S ) + ( 6- ) = 0
( S ) = ( 6+ )
مثال (2):
احسب عدد تأكسد الكبريت في الأيون S2O82- .
الحل:
(عدد تأكسد S × عدد ذراته)
+ (عدد تأكسد O × عدد ذراته) = -2
( 2 x S ) + ( 8 x 2- ) = 2-
( 2S ) + ( 16- ) = 2-
( 2S ) = 14+
( S ) = ( 7+ )
ماذا تلاحظ بالنسبة لعدد تأكسد الكبريت في المثالين السابقين، هل هو ثابت أم متغير؟
إعداد : شبكة منهاجي التعليمية
13 / 11 / 2017
النقاشات