قوى لندن
London forces
قوى لندن: قوى تجاذب ضعيفة تنشأ نتيجة الاستقطاب اللحظي للجزيئات أو الذرات.
كيف تتكون قوى لندن
لنأخذ مثلاً ذرة الآرغون، حيث يفترض أن يكون توزيع الشحنات السالبة حول النواة الموجبة منتظماً، إلا أنه للحظة قصيرة من الزمن تتجمع الشحنات السالبة في أحد طرفي الذرة، فتحمل حينئذ شحنة جزئية سالبة، ويحمل الطرف الآخر شحنة جزئية موجبة.
ويسمى هذا التوزيع غير المنتظم للشحنات ثنائي القطب اللحظي، ويؤثر ثنائي القطب اللحظي في الذرات المجاورة ويجعلها مستقطبة بالحث، فينشأ عن ذلك قوى تجاذب فيما بينها يعرف بقوى لندن.
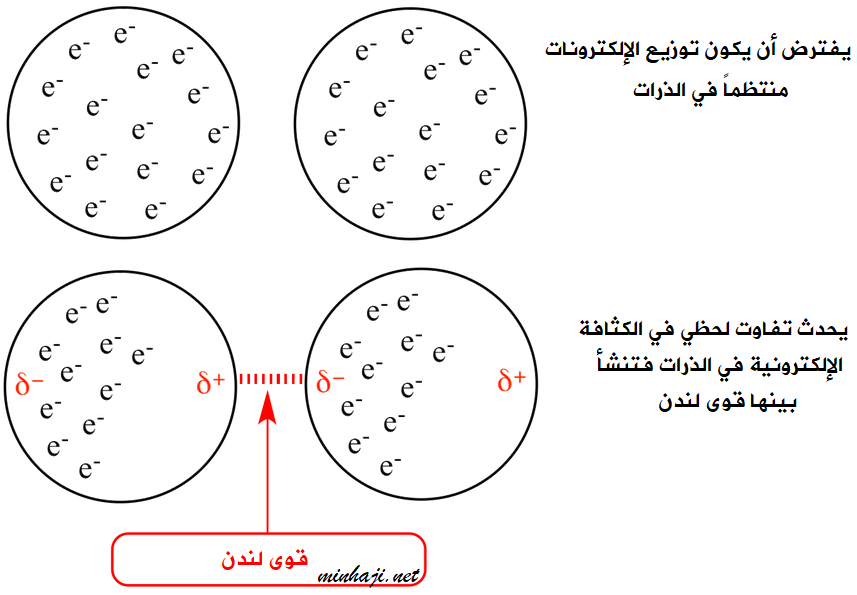
تعتبر قوى لندن ضعيفة لأنها تنشأ عن استقطاب لحظي يظهر للحظة قصيرة من الزمن ويختفي بعدها.
تتكون قوى لندن بين جميع أنواع الجزيئات سواء أكانت قطبية أم غير قطبية ولكنها تكتسب أهمية خاصة في الجزيئات غير القطبية، وفي الغازات النبيلة لأنها قوى التجاذب الوحيدة العاملة بين ذراتها.
العوامل المؤثرة في قوى لندن
- الكتلة المولية (أو العدد الذري): بزيادة الكتلة المولية للجزيء تزداد قوى لندن.
- شكل الجزيء: كلما زادت نقاط التجاذب بين الجزيئات زادت قوى لندن.
ويستخدم هذا العامل عند تساوي الكتلة المولية للمركبين.
سؤال (1):
رتب الجزيئات التالية حسب تزايد قوى الترابط بين جزيئاتها في الحالة السائلة:
CCl4 , CF4 , CH4 , CI4 , CBr4
العدد الذري لـ H = 1 ، F = 9 ، Cl = 17 ، Br = 35 ، I = 53
الحل:
جميع الجزيئات في السؤال ذات شكل رباعي الأوجه منتظم، وجميعها جزيئات غير قطبية، لذا فهي تترابط بقوى لندن الضعيفة، ولترتيبها حسب قوى لندن ننظر إلى كتلها المولية أو أعدادها الذرية، فبزيادة الكتلة المولية أو العدد الذري تزداد قوى لندن وتزداد معها قوى التجاذب بين الجزيئات، ويكون الترتيب على النحو التالي:
CH4 < CF4 < CCl4 < CBr4 < CI4
سؤال (2):
أي الجزيئات التالية تملك أعلى قوى ترابط بين جزيئاتها وهي في الحالة السائلة:
C2H6 , C4H10 , CH4 , C3H8
الحل:
المركبات الهيدروكربونية غير قطبية، تترابط جزيئاتها بقوى لندن الضعيفة، ولترتيبها حسب قوى لندن ننظر إلى كتلها المولية التي تزداد بزيادة عدد ذرات الكربون، ويكون الترتيب على النحو التالي:
CH4 < C2H6 < C3H8 < C4H10
أثر قوى لندن على خصائص الجزيئات
زيادة قوى لندن تعمل على زيادة قوى التجاذب بين الجزيئات فتزداد درجة غليان المركب، كما أن زيادة قوى لندن تؤثر في الحالة الفيزيائية للمادة.
انظر إلى الجدول التالي والذي يمثل جزيئات عناصر المجموعة السابعة (A) من الجدول الدوري:
|
صيغة الجزيء |
الكتلة المولية للجزيء غ / مول |
قوى التجاذب |
درجة الغليان |
الحالة الفيزيائية |
|
F2 |
38 |
لندن |
-188 |
غاز |
|
Cl2 |
71 |
لندن |
-43.6 |
غاز |
|
Br2 |
160 |
لندن |
59 |
سائل |
|
I2 |
254 |
لندن |
184 |
صلب |
لاحظ أن زيادة الكتلة المولية للجزيء تعمل على زيادة درجة الغليان، كما أن زيادة قوى لندن تؤثر في الحالة الفيزيائية للمادة وتزيد التجاذب بين جزيئاتها.
سؤال (1):
أي الجزيئات التالية تملك أعلى درجة غليان وهي في الحالة السائلة؟
CH3CH3 , CH3CH2CH3 , CH3CH2CH2CH3
الحل:
جميع هذه المركبات هيدروكربونات، وهي مركبات غير قطبية، تترابط جزيئاتها بقوى لندن الضعيفة، إلا أنها تختلف فيما بينها في الكتله المولية، ويمكن أن نعرف أي الجزيئات أكبر في الكتلة المولية من خلال مقارنة الجزيئات الثلاثة من حيث عدد ذرات الكربون، فكلما زاد عدد ذرات الكربون زادت الكتلة المولية وزادت درجة الغليان، وعليه يمتلك المركب CH3CH2CH2CH3 درجة غليان أعلى.
سؤال (2):
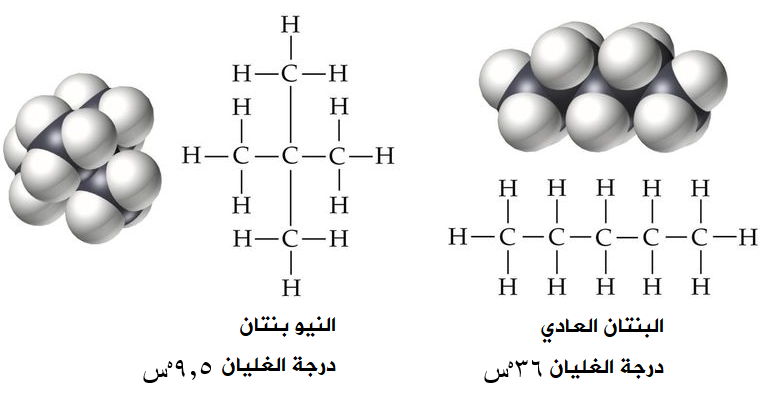
يشترك البنتان العادي والنيوبنتان (ثنائي ميثيل بروبان) في الصيغة الجزيئية C5H12 ، وعلى الرغم من تشابههما في الكتلة المولية وكونهما غير قطبيين إلا أن درجة غليان البروبان العادي أعلى، فكيف تفسر ذلك؟
الحل:
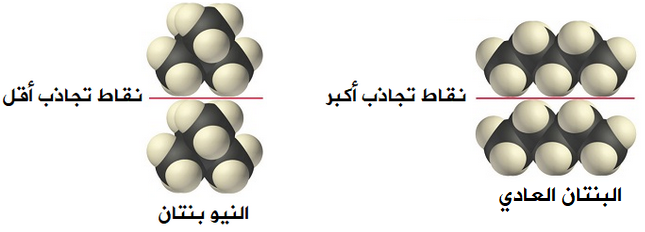
يختلف الجزيئان عن بعضهما في الشكل، إذ يتخذ جزيء البنتان العادي شكل السلسلة، بينما يتخذ جزيء النيوبنتان شكل الكرة، وهكذا فإن نقاط التجاذب بين جزيئات البنتان على طول السلسلة، أما في حالة جزيء النيوبنتان فإن نقاط التجاذب محدودة، ومن ثم نتوقع قوة تجاذب أكبر بين جزيئات البنتان العادي، فتزداد قوى لندن وتزداد درجة الغليان.
إعداد : أ. أحمد الحسين
16 / 10 / 2021
النقاشات