 |
أسئلة المحتوى وإجاباتها
أتحقق صفحة (158):
أدرس الجدول (8)، ثم أجيب عن الأسئلة الآتية:
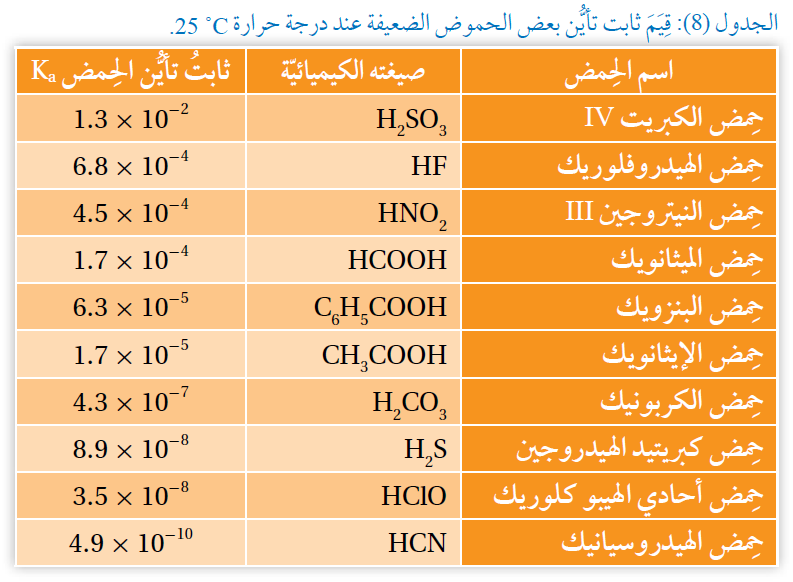
1- أحدد الحمض الأقوى: HCOOH أم H2CO3
2- أتوقع أيها له أقل رقم هيدروجيني: محلول الحمض HNO2 أم محلول الحمض HClO . علماً أن لهما التركيز نفسه.
3- أتوقع أيها يحتوي على أعلى تركيز من أيونات OH- بين الحموض: HF, HClO, CH3COOH ؟
الحل:
1- الحمض الأقوى: HCOOH ؛ لأن له قيمة ثابت تأين Ka أعلى.
2- محلول الحمض HNO2 له أقل رقم هيدروجيني؛ لأن له قيمة ثابت تأين Ka أعلى.
3- أعلى تركيز من أيونات OH- في محلول الحمض؛ لأن له قيمة ثابت تأين Ka أقل.
أتحقق صفحة (159):
أحسب تركيز أيونات H3O+ في محلول حمض النيتروجين (III) HNO2، الذي تركيزه 0.03 M علماً أن Ka = 4.5 x 10-4
الحل:
أكتب معادلة تأين الحمض:
HNO2 + H2O H3O+ + NO2-
أكتب قانون ثابت تأين الحمض:
Ka = = [H3O+] = [NO2-]
أعوض تركيز الحمض عند الاتزان، وقيمة Ka :
4.5 x 10-4 =
x2 = 4.5 x 10-4 x 0.03 = 13.5 x 10-6
وبأخذ جذر الطرفين:
x = [H3O+] = 3.7 x 10-3 M
أتحقق صفحة (160):
أحسب الرقم الهيدروجيني pH لمحلول حمض الهيدروسيانيك HCN ، الذي تركيزه 0.02 M
علماً أن Ka = 4.9 x 10-10 , log 3.13 = 0.5
الحل:
أكتب معادلة تأين الحمض:
HCN + H2O H3O+ + CN-
أكتب قانون ثابت الاتزان:
Ka = = [H3O+] = [CN-]
أعوض تركيز الحمض عند الاتزان، وقيمة Ka :
4.9 x 10-10 =
x2 = 4.9 x 10-10 x 0.02 = 9.8 x 10-12
وبأخذ جذر الطرفين:
x = [H3O+] = 3.13 x 10-6 M
أتحقق صفحة (162):
أحسب كتلة حمض الميثانويك HCOOH اللازمة لتحضير محلول منه حجمه 0.5 L ورقمه الهيدروجيني يساوي 3 علماً أن Ka = 1.7 x 10-4 ,Mr = 46 g/mol
الحل:
أحسب تركيز أيون H3O+ من قيمة الرقم الهيدروجيني:
[H3O+] = 10-pH
[H3O+] = 10-pH = 10-3 = 1 x 10-3 M
أكتب معادلة ثابت تأين الحمض:
HCOOH(aq) + H2O(l) HCOO-(aq) + H3O+(aq)
أكتب قانون ثابت تأين الحمض:
Ka = = [H3O+] = [HCOO-]
أعوض تركيز أيون الهيدرونيوم عند الاتزان، وقيمة Ka :
1.7 x 10-4 =
[HCOOH] = 5.9 x 10-3 M
أحسب عدد مولات الحمض (n) من تركيز الحمض وحجمه:
n = M x V = 5.9 x 10-3 x 0.5 = 2.95 x 10-3 mol
أحسب كتلة الحمض (m) من عدد مولاته وكتلته المولية:
m = n x Mr = 2.95 x 10-3 x 46 = 135.7 x 10-3 g
أتحقق صفحة (163):
بالرجوع إلى الجدول (9)، أجيب عن الأسئلة الآتية:
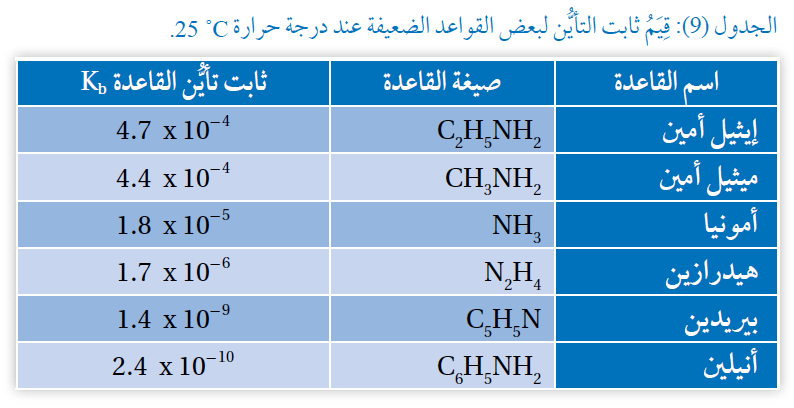
1- أتوقع المحلول الذي له أقل رقم هيدروجيني NH3 أم C5H5N . علماً أن لهما التركيز نفسه.
2- أحدد القاعدة الأقوى في الجدول.
3- أحدد القاعدة التي يكون حمضها المرافق أقل رقم هيدروجيني: CH3NH2 أم N2H4
الحل:
1- المحلول الذي له أقل رقم هيدروجيني هو: C5H5N ؛ لأن لها قيمة Kb أقل.
2- القاعدة الأقوى في الجدول هي: C2H5NH2 ؛ لأن لها قيمة Kb أعلى.
3- القاعدة التي يكون حمضها المرافق أقل رقم هيدروجيني هي: N2H4
أتحقق صفحة (164):
تتأين الهيدرازين N2H4 ذات التركيز 0.04 M ، وفق المعادلة الآتية:
N2H4 (aq) + H2O (l) N2H5+ (aq) + OH- (aq)
أحسب تركيز أيونات OH- في المحلول. علماً أن ثابت تأين الهيدرازين Kb = 1.7 x 10-6
الحل:
أكتب معادلة تأين القاعدة:
N2H4 (aq) + H2O (l) N2H5+ (aq) + OH- (aq)
أكتب قانون ثابت تأين الحمض:
Kb = = [OH-] = [N2H5+]
أعوض تركيز القاعدة عند الاتزان، وقيمة Kb :
1.7 x 10-6 =
x2 = 1.7 x 10-6 x 0.04 = 6.8 x 10-8
وبأخذ جذر الطرفين:
x = [OH-] = 2.6 x 10-4 M
أتحقق صفحة (165):
أحسب الرقم الهيدروجيني لمحلول الأمونيا NH3 ، الذي تركيزه 0.02 M علماً أن:
log 1.66 = 0.22 , Kb = 1.8 x 10-5
الحل:
أكتب معادلة تأين القاعدة:
NH3 (aq) + H2O (l) NH4+ (aq) + OH- (aq)
أكتب قانون ثابت تأين الحمض:
Kb = = [OH-] = [NH4+]
أعوض تركيز القاعدة عند الاتزان، وقيمة Kb :
1.8 x 10-5 =
x2 = 1.8 x 10-5 x 0.02 = 36 x 10-8
وبأخذ جذر الطرفين:
x = [OH-] = 6 x 10-4 M
أحسب قيمة تركيز H3O+ من علاقة Kw :
[OH-] [H3O+] = 1 x 10-14 Kw =
0.166 x 10-10 = 1.66 x 10-11 M [H3O+] = = =
أحسب قيمة pH :
pH = - log [H3O+]
pH = - log (1.66 x 10-11) = 11 – log 1.66 = 11 – 0.22 = 10.78
أتحقق صفحة (166):
أحسب ثابت تأين القاعدة بيوتيل أمين C4H9NH2، التي تركيزها 0.4 M ورقمها الهيدروجيني 12
الحل:
أحسب تركيز H3O+ من قيمة pH :
[H3O+] = 10-pH = 10-12 = 1 x10-12 M
أحسب قيمة تركيز OH- من علاقة Kw :
[OH-] [H3O+] = 1 x 10-14 Kw =
[OH-] = = = 1 x 10-2 M
أكتب معادلة تأين القاعدة:
C4H9NH2 (aq) + H2O (l) C4H9NH3+ (aq) + OH- (aq)
أكتب قانون ثابت تأين الحمض:
Kb = = [OH-] = [C4H9NH3+]
أعوض تركيز القاعدة وتركيز أيون الهيدروكسيد عند الاتزان:
Kb =
Kb = 0.25 x 10-3