أسئلة تقييم الدرس الأول
تركيب الذرة
السؤال الأول:
اختر الإجابة الصحيحة للأسئلة من (1) : (8).
(1) ما أصغر المكونات دون الذرية من حيث الكتلة؟
أ- البروتونات.
ب- النيوترونات
ج- الإلكترونات.
د- النيوكلونات.
(2) أي المكونات دون الذرية التالية تكون كتلتها 1 u؟
أ- البروتونات فقط.
ب- الإلكترونات فقط.
ج- النيوترونات والإلكترونات.
د- النيوترونات والبروتونات.
(3) الشكل التالي يوضح تركيب الذرة (X):
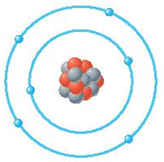
ما الرمز المعبر عن هذه الذرة؟
أ-
ب-
ج-
د-
(4) أي من الذرات التالية يكون عدد النيوترونات بنواتها ضعف عدد البروتونات؟
أ-
ب-
ج-
د-
(5) تحتوى نواة ذرة البوتاسيوم على 19 بروتون وتكون طاقة الإلكترون فيه أكبر ما يمكن في مستوى الطاقة ............
أ- الأول.
ب- الثاني.
ج- الثالث.
د- الرابع.
(6) ما العدد الذي تتفق فيه كل ذرات العنصر الواحد؟
أ- العدد الكتلى.
ب- عدد الإلكترونات.
ج- عدد النيوترونات.
د- عدد النيوكلونات.
(7) أي الاختيارات التالية يدل على أن ذرة العنصر متعادلة الشحنة؟
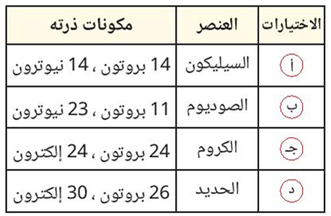
ج- الكروم.
(8) عنصر تتوزع إلكترونات ذرته في 3 مستويات طاقة، ويدور في مستوى الطاقة الخارجي لذرته 3 إلكترونات وتحتوى نواته على 14 نيوترون يكون عدده الكتلى؟
أ- 3
ب- 13
ج- 14
د- 27
السؤال الثاني:
عنصر (X) تحتوى نواة ذرته على 20 جسيم متعادل الشحنة وعدد النيوكلونات فيه 39:
(1) ما عدد الجسيمات سالبة الشحنة في هذه الذرة؟
عدد البروتونات = عدد النيوكلونات – عدد النيوترونات
عدد البروتونات = 39 – 20 = 19
إذن عدد الجسيمات سالبة الشحنة = عدد البروتونات = 19
(2) اكتب رمز هذا العنصر متضمناً أعداد الرمزين A ، Z
السؤال الثالث:
من نظائر الأكسجين نظير الأكسجين -17 لماذا لا يمكن معرفة عدد النيوترونات في نواة هذا النظير بمعلومية العدد 17 فقط؟
لأن عدد النيوترونات يساوي الفرق بين العدد الكتلي (17) والعدد الذري.
السؤال الرابع:
 الشكل المقابل:
الشكل المقابل:
يمثل شبيهًا لنموذج الذرة.
ما الذي يمثله النحل وخلية النحل في هذا النموذج؟
- النحل: يمثل الإلكترونات التي تدور حول النواة.
- خلية النحل: تمثل نواة الذرة.
إعداد : شبكة منهاجي التعليمية
26 / 06 / 2025
النقاشات