إجابات أسئلة مراجعة الوحدة الثالثة
الكيمياء الحركية
السؤال الأول:
أوضح المقصود بكل من: طاقة تنشيط التفاعل، الرتبة الكلية للتفاعل، سرعة التفاعل الكيميائي.
طاقة تنشيط التفاعل: الحد الأدنى من الطاقة الحركية التي يجب أن تمتلكها الجسيمات المتفاعلة كي تبدأ التفاعل، وتكوين روابط جديدة.
الرتبة الكلية للتفاعل: مجموع رتب المواد المتفاعلة في قانون سرعة التفاعل الكيميائي.
سرعة التفاعل الكيميائي: التغير في كمية مادة متفاعلة أو ناتجة خلال مدة زمنية محددة.
السؤال الثاني:
أفسر ما يأتي:
أ- لا تؤدي جميع التصادمات إلى حدوث تفاعل كيميائي.
لأنه قد لا يتوفر الاتجاه الصحيح (المناسب)، والطاقة الكافية في الجسيمات المتصادمة.
ب- زيادة سرعة التفاعل بإضافة عامل مساعد.
العامل المساعد يمهد مسار بديل للتفاعل أكثر سهولة؛ مما يقلل من طاقة التنشيط للتفاعل، فتزداد سرعة التفاعل.
السؤال الثالث:
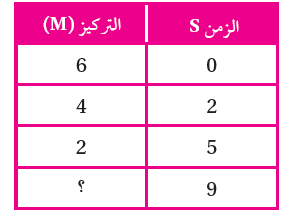 يبين الجدول الآتي تراكيز مادة افتراضية خلال مدد زمنية مختلفة.
يبين الجدول الآتي تراكيز مادة افتراضية خلال مدد زمنية مختلفة.
أ- أستنتج في ما إذا كانت المادة متفاعلة أم ناتجة؟ أفسر إجابتي.
المادة متفاعلة؛ لأن تركيزها يقل مع الزمن.
ب- أحسب سرعة التفاعل خلال الفترة الزمنية (0 - 2).
R = - = - = 1 M/s
ج- أتوقع: كم يصبح تركيز المادة عند الزمن 9s (أكبر من 2 أم أقل)؟ أفسر إجابتي.
أقل من 2؛ لأن المادة متفاعلة يقل تركيزها مع الزمن.
السؤال الرابع:
في التفاعل الافتراضي الآتي: A(g) + 2B(g) → 3C(g)
أحسب سرعة تكوين C ؛ علماً أنّ سرعة استهلاك B يساوي 0.12 Ms-1
R = - =
- x 0.12 =
= 0.18 M/s
السؤال الخامس:
يمثل الشكلان (أ، ب) تفاعلاً في ظرفين مختلفين.

أستنتج أي الشكلين يمثل التفاعل الأسرع؟ وأحدد العامل المؤثر في سرعة التفاعل؟
الشكل (ب) هو الأسرع؛ لأن عدد الجسيمات في وحدة الحجم في الشكل (ب) أكبر من عدد الجسيمات في الشكل (أ)، وبزيادة عدد الجسيمات يزداد التركيز، وتزداد عدد التصادمات الفعللة وتزداد سرعة التفاعل.
السؤال السادس:
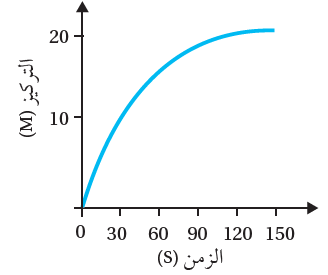 يمثل الرسم البياني العلاقة بين الزمن وتركيز مادة في تفاعل كيميائي.
يمثل الرسم البياني العلاقة بين الزمن وتركيز مادة في تفاعل كيميائي.
أ- أحدد الزمن اللازم لإتمام التفاعل؟
150 s
ب- أحسب سرعة التفاعل في المدة الزمنية (30 – 90 s).
R = = = 0.167 M/s
ج- أستنتج هل المادة متفاعلة أم ناتجة؟
ناتجة؛ لأن التركيز يزداد بمرور الزمن.
السؤال السابع:
أستنتج سرعة التفاعل من المعلومات الواردة في الجدول الآتي:
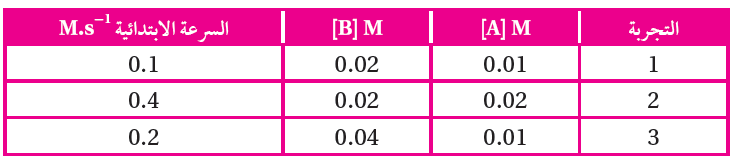
رتبة المادة (A) = 2
رتبة المادة (B) = 1
قانون السرعة: R = k [A]2 [B]1
السؤال الثامن:
أتوقع من الشكلين الآتيين (أ، ب) العامل المؤثر في حدوث التفاعل الكيميائي، ثم أفسر إجابتي.
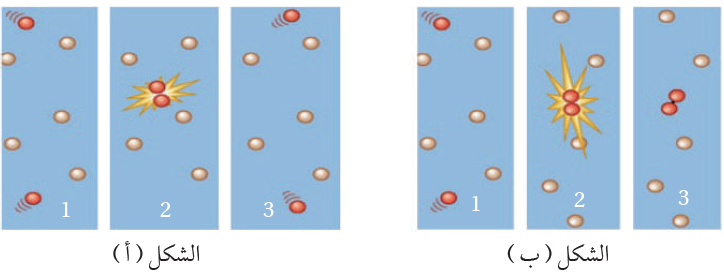
ألاحظ من الشكلين أنه حدث تصادم بين جسيمين متفاعلين، ولكن في الشكل (أ) ارتد الجسيمان عن بعضهما. أما في الشكل (ب) فإن الجسيمان ارتبطا ببعضهما؛ ما يدل على أنه حدث تصادم فعال، وأن العامل المؤثر هو توفر الطاقة الكافية للتصادم.
السؤال التاسع:
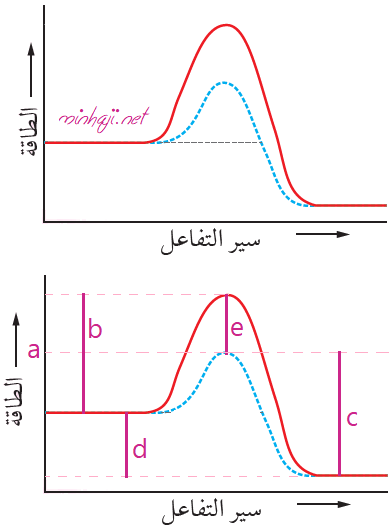 يمثل الشكل الآتي سير تفاعل بوجود عامل مساعد ودون عامل مساعد، أحدد على الشكل كلاً من:
يمثل الشكل الآتي سير تفاعل بوجود عامل مساعد ودون عامل مساعد، أحدد على الشكل كلاً من:
طاقة المعقد المنشط بوجود عامل مساعد، طاقة تنشيط التفاعل الأمامي دون عامل مساعد، طاقة تنشيط التفاعل العكسي بوجود عامل مساعد، التغير في المحتوى الحراري للتفاعل، الانخفاض في طاقة المعقد المنشط نتيجة إضافة عامل مساعد.
طاقة المعقد المنشط بوجود عامل مساعد: a
طاقة تنشيط التفاعل الأمامي دون عامل مساعد: b
طاقة تنشيط التفاعل العكسي بوجود عامل مساعد: c
التغير في المحتوى الحراري للتفاعل: d
الانخفاض في طاقة المعقد المنشط نتيجة إضافة عامل مساعد: e
السؤال العاشر:
جمعت البيانات الافتراضية الآتية للتفاعل X + Y → XY
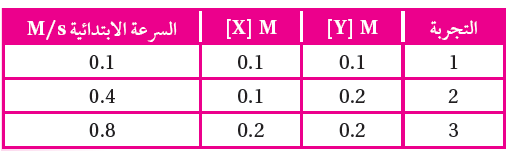
أ- أكتب الصيغة العامة لقانون السرعة.
R = k [X]x [Y]y
ب- أكتب قانون سرعة التفاعل.
رتبة المادة (X) = 1
رتبة المادة (Y) = 2
قانون السرعة: R = k [X]1 [Y]2
ج- أجد قيمة (k) ووحدته.
R = k [X]1 [Y]2
0.1 = k [0.1]1 [0.1]2
k = 100 M-2/s
السؤال الحادي عشر:
جمعت البيانات الافتراضية الآتية للتفاعل A + B + C → D + 2E
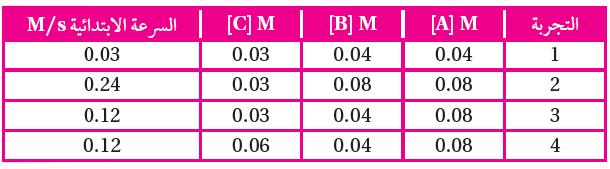
أ- أكتب الصيغة العامة لقانون السرعة.
R = k [A]x [B]y [C]z
ب- أكتب قانون سرعة التفاعل.
رتبة المادة (A) = 2
رتبة المادة (B) = 1
رتبة المادة (C) = 0
قانون السرعة: R = k [A]2 [B]1
ج- أجد قيمة (k) ووحدته.
R = k [A]2 [B]1
0.03 = k [0.04]2 [0.04]1
k = 470 M2/s
السؤال الثاني عشر:
أختار الإجابة الصحيحة:
1- في التفاعل الافتراضي2A + 2B → 4D ؛ إذا كانت رتبة التفاعل للمادة A = zero ، وثابت السرعة k = 0.1 M-1s-1 ؛ فإن رتبة التفاعل للمادة B تساوي:
أ- صفراً
ب- 1
ج- 2
د- 3
2- العبارة الصحيحة في ما يتعلق بالعامل المساعد:
أ- يزيد من طاقة التنشيط.
ب- يقلل من طاقة المعقد المنشط.
ج- يقلل المحتوى الحراري للتفاعل.
د- يزيد من طاقة النواتج.
3- عند زيادة مساحة سطح المادة المتفاعلة المعرض للتفاعل عند الظروف نفسها؛ فإن العبارة الصحيحة:
أ- تقل سرعة التفاعل.
ب- يزداد التركيز.
ج- تزداد عدد التصادمات الفعالة.
د- تقل درجة الحرارة.
4- إذا كانت طاقة التنشيط للتفاعل الأمامي 70 kJ وكان التغير في المحتوى الحراري -50 kJ؛ فإن طاقة التنشيط للتفاعل العكسي تساوي بوحدة kJ:
أ- 20
ب- 50
ج- 70
د- 120
5- في تفاعل ما تؤدي زيادة درجة حرارة التفاعل إلى:
أ- زيادة طاقة التنشيط.
ب- تقليل سرعة التفاعل.
ج- زيادة عدد التصادمات الفعالة.
د- تقليل متوسط الطاقة الحركية.
6- وجد في تفاعل افتراضي أن مضاعفة تركيز A لا يؤثر في سرعة التفاعل، وأن مضاعفة تركيز B ثلاث مرات؛ ضاعف سرعة التفاعل تسع مرات؛ فيكون قانون سرعة هذا التفاعل:
أ- R = k [B]2
ب- R = k [A]1[B]1
ج- R = k [A]2[B]1
د- R = k [A]2
7- في تفاعل ما كانت طاقة التنشيط للتفاعل الأمامي (70 kJ)، وطاقة التنشيط للتفاعل العكسي (50 kJ)؛ فإن قيمة التغير في المحتوى الحراري للتفاعل تساوي:
أ- 20+
ب- 20-
ج- 120+
د- 120-
8- تفاعل فلز المغنيسيوم مع الماء أبطأ من فلز الصوديوم في الظروف نفسها، ويعود ذلك إلى:
أ- درجة الحرارة.
ب- طبيعة المتفاعلات.
ج- التركيز.
د- العامل المساعد.
9- في تجربة ما؛ جرى الحصول على البيانات عند درجة حرارة معينة لتفاعل مادتين A و B ؛ أجيب عن الأسئلة (أ، ب) التي تليه:
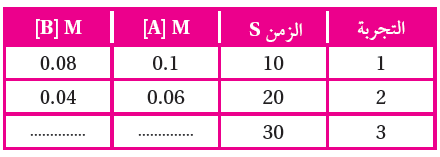
أ) أستنتج سرعة تفاعل المادة A في الفترة الزمنية (10 – 20 s) بوحدة M/s ؟
أ- 0.4
ب- 0.04
ج- 0.004
د- 0.0004
ب) أستنتج: أي التراكيز الآتية صحيحاً للمادتين A و B في التجربة رقم (3)؟
أ- 0.07 = [B] , 0.03 = [A]
ب- 0.01 = [B] , 0.08 = [A]
ج- 0.03 = [B] , 0.04 = [A]
د- 0.08 = [B] , 0.09 = [A]
السؤال الثالث عشر:
يبين الشكل الآتي تغير الطاقة خلال سير التفاعل أدرس الشكل وأجيب عن الأسئلة الآتية:
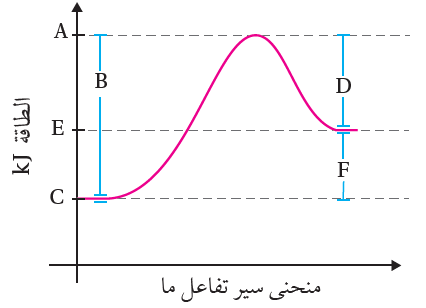 ما الرمز الذي يمثل كلاً ممّا يأتي:
ما الرمز الذي يمثل كلاً ممّا يأتي:
أ- طاقة المواد المتفاعلة. C
ب- طاقة المواد الناتجة. E
ج- طاقة المعقد المنشط. A
د- التغير في المحتوى الحراري. F
هـ- طاقة تنشيط التفاعل الأمامي. B
و- طاقة تنشيط التفاعل العكسي. D
السؤال الرابع عشر:
اعتماداً على البيانات في الجدول الآتي لتفاعل ما؛ ما قيمة كلّ من الرموز (أ، ب، ج، د)؟

(أ): 40 kJ ، (ب): 210 kJ ، (ج): 140 kJ ، (د): 110 kJ
إعداد : شبكة منهاجي التعليمية
18 / 02 / 2024
النقاشات
Anjoma Shawaqfeh
سؤال 10 الفرع ب الجواب خاطئ قيمة k =100
إضافة رد
1 ردود
Tala Smadi
مكتوب ١٠٠ ب فرع ج