تركيز المواد المتفاعلة
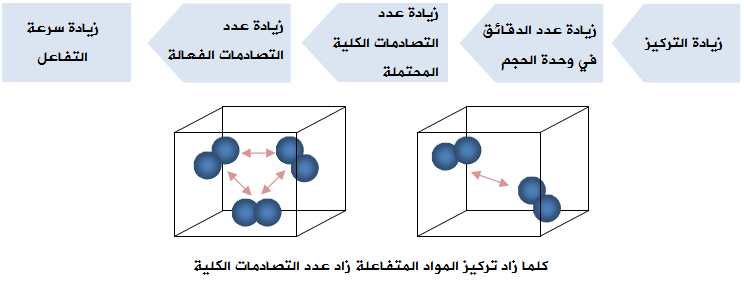
زيادة تركيز أحد المواد المتفاعلة يؤدي إلى زيادة سرعة التفاعل، ويمكن تفسير أثر التركيز على سرعة التفاعل اعتماداً على نظرية التصادم على النحو التالي:
فعند زيادة تراكيز المواد المتفاعلة يزداد عدد الدقائق في وحدة الحجم، ويزداد معها عدد التصادمات الكلية المحتملة بين دقائقها، وبالتالي يزداد عدد التصادمات الفعالة، فتزداد سرعة التفاعل.
مثال:
يتفاعل المغنيسيوم مع حمض الهيدروكلوريك HCl وفق التفاعل:
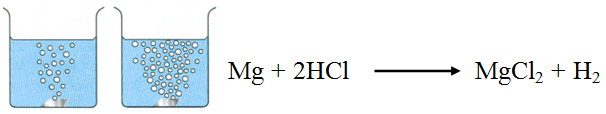
تزداد سرعة تصاعد غاز الهيدروجين الناتج من تفاعل المغنيسيوم مع حمض الهيدروكلوريك بزيادة تركيز الحمض.
فسّر ذلك بالاعتماد على نظرية التصادم.
التفسير:
زيادة تركيز HCl يزيد من عدد أيونات H+ و Cl- الموجودة في وحدة الحجم، فيزداد عدد التصادمات الكلية المحتملة بينها وبين دقائق المغنيسيوم، فيزداد عدد التصادمات الكلية المحتملة، وزيادة عدد التصادمات الفعالة، فتزداد سرعة التفاعل.
إعداد : شبكة منهاجي التعليمية
22 / 01 / 2023
النقاشات