مراجعة الدرس الأول
الحموض والقواعد
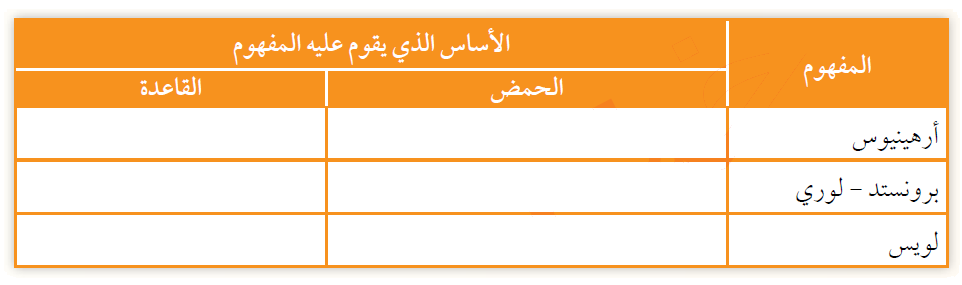
1- أكمل الجدول الآتي باستخدام الأسس التي اعتمد عليها مفهوم الحمض والقاعدة:
2- أوضح المقصود بكل ممّا يأتي:
- حمض أرهينيوس.
- حمض برونستد – لوري.
- قاعدة لويس.
- مادة أمفوتيرية.
3- أفسر:
- السلوك الحمض لمحلول حمض HClO حسب مفهوم أرهينيوس.
- السلوك القاعدي لمحلول C2H5NH2 حسب مفهوم برونستد – لوري.
- يعد الحمض HBr حمضاً قوياً بينما يعد HNO2 حمضاً ضعيفاً.
4- أصنف المحاليل الآتية إلى حموض وقواعد قوية أو ضعيفة:
H2SO3 , HI , KOH , HF , NH3 , N2H4
5- أحدد الأزواج المترافقة في التفاعلين الآتيين:
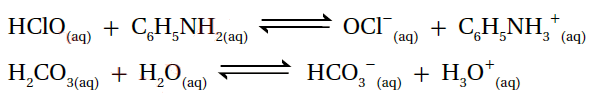
6- أحدد الحمض والقاعدة وفق مفهوم لويس في المعادلة الآتية:
Fe(H2O)63+(aq) Fe3+(aq) + 6H2O(l)
7- أفسر السلوك الأمفوتيري للأيون H2PO4- عند تفاعله مع كل من HNO3 و CN- ، موضحاً إجابتي بالمعادلات.
8- أختار الاجابة الصحيحة لكل فقرة مما يأتي:
1. تعد الأمونيا NH3 قاعدة عند تفاعلها مع الماء وفق مفهوم برونستد - لوري لأنها:
أ. تستقبل بروتون.
ب. تمنح بروتون.
ج. تستقبل OH.
د. تمنح OH.
2. الأيون الذي يُمثل القاعدة المرافقة الأقوى فيما يأتي:
أ. Cl-
ب. NO3-
ج. CN-
د. ClO4-
3. أحد الآتية زوج مترافق ينتج من تفاعل N2H4 مع NH4+، وهو:
أ. N2H4/NH4+
ب. N2H5+/NH3
ج. N2H4/N2H5+
د. N2H5+/NH4+
4. يسلك الأيون HS- سلوكًا حمضياً عند تفاعله مع:
أ. HF
ب. HCOOH
ج. OH-
د. NH4+
5. لم يستطع أرهينيوس تفسير السلوك الحمضي لـ:
أ. HCN
ب. HClO
ج. HI
د. NH4Cl
6. في التفاعل الآتي؛ تكون الصيغة الكيميائية لـ A هي:
A(aq) + CN-(aq) HPO42-(aq) + HCN(aq)
أ. H3PO4
ب. H2PO4-
ج. H2PO42-
د. PH43-
إعداد : شبكة منهاجي التعليمية
16 / 11 / 2025
النقاشات